باتری آهن هوا، ویژگی ها و ساختار آن
تاریخچۀ
باتری آهن هوا به دلیل کم هزینه بودن و اکسیده شدن، آسان قابلیت رسوب از یک الکترولیت آبی به عنوان یک فلز مناسب برای استفاده در باتریهای قابل شارژ به شمار میآید.
سلول آهن هوا را میتوان به عنوان جایگزینی برای سلول قلیایی اکسید آهن-نیکل در نظر گرفت که در آن الکترود نیکل را میتوان با یک الکترود هوای دوکاره تعویض کرد.
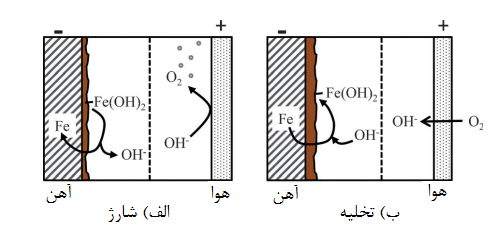
نمای کلی سلول که در شکل 1 نشان داده شده است، فرآیندهای مهمی را که در زمان تخلیه و شارژ رخ میدهند نشان میدهد.
شکل1. سلول آهن-هوا با یک پوشش آنیون در یک الکترولیت قلیایی که در فرایندهای اصلی هنگام چرخۀ
الف) شارژ و ب) تخلیه رخ میدهد
پتانسیل سلول مدار-باز باتری آهن هوا 1.28 ولت است، یعنی اندکی کمتر از سلول اکسید آهن – نیکل که مقدار 1.41 ولت است، اما با جا به جایی نیکل با یک یک الکترود هوا میتوان چگالی انرژی را تا 100٪ افزایش داد.
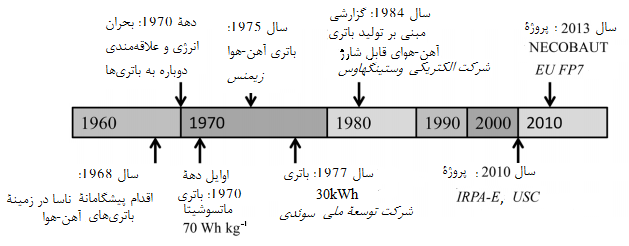
در شکل 2 سیر تحول باتری آهن هوا در گذر زمان نشان داده شده است. در دهۀ 1970 از این مفهوم توسط شرکت توسعۀ ملی سوئد به منظور تولید باتری 30 kWh برای کاربردهای کشش برقی با چگالی انرژی برابر با با مداومت 5 ساعت بهره برداری شد. [1]
شکل2. سیر تحول پیشرفتهای مهم در باتری آهن هوا
این باتریها برای کاربرد در وسایل نقلیه مناسب بوده و مواد اولیۀ ساخت آنها ارزان قیمت بوده و به آسانی و فراوانی در دسترس هستند.
پیش تر نیز یک سری کارهای پژوهشی توسط ناسا بر روی باتریهای آهن-هوا انجام شد، که طی این تحقیقات یک باتری با قابلیت انرژی Ah20-5 که قابلیت سیکل پذیری آنها کمتر از 200 سیکل و چگالی انرژی آن نیز بود ساخته شد.
مزیت اصلی این باتریها آن بود که هرگز هنگام شارژ دندریتهای فلزی ایجاد نمیشد. از سویی دیگر آزاد شدن هیدروژن، تخلیۀ خود به خود باتری و هدر رفت آب از جمله معایب آن هاست. با وجود این محدودیت ها، شرکت الکتریکی وستینگهاوس [5, 4] یک سلول پایدار با ویژگیهای قابل قبول از باتری آهن هوا با سطح مقطع 100 سانتی متر مربع طراحی و آن را به بازار معرفی کرد.
آن ها پیش بینی کردند که این باتری در قالب ماژولهایی با سطح 400 سانتی متر مربعی با انرژی مشخصی برابر با قابلیت دستیابی به 1000 سیکل با هزینۀ تولید برابر با 30 دلار برای هر کیلووات ساعت قابل تولید است. [6]
در دهۀ 1970 شرکتهای زیمنس آلمان و ماتسوشیتا ژاپن نیز هر دو در زمینۀ پژوهش و تولید باتری آهن هوا فعالیت داشتند. علاقه به این فناوری بیشتر ناشی از بحران نفتی دهۀ 1970 و احتمال ناچاری به استفاده از وسایل نقلیۀ برقی بود.
در سالهای اخیر دوباره فناوری باتری آهن هوا مورد توجه قرار گرفت که این توجه را مدیون پیشرفت های اخیر در فناوری نانو است که امکان استفاده از کاتالیزورهای الکترودی نانوساختار کارامد به منظور دستیابی به میزان بالاتر چگالی انرژی را از طریق استفاده از سطح بیشتری از ذرات نانو Fe (آهن) فراهم کرده است.
کم هزینه بودن و در دسترس بودن آهن و اکسیژن جوی امتیازات دیگر آن به شمار میآیند. دو نمونه از اقدامات اخیر در این زمینه عبارتند از:
1-پروژهای در دانشگاه کالیفرنیای جنوبی در زمینۀ باتری آهن هوا با قابلیت شارژ مجدد. [7]
2-پروژۀ اروپایی تحت حمایت FP7 ، NECOBAUT، که به دنبال آزمایش امکان استفاده از یک نوع باتری آهن هوا برای کاربرد در خودرو و وسایل نقلیه بوده است. [8]
این مرور اجمالی پژوهشهای پیشین انجام شده بر روی سیستم باتری آهن هوا را شامل میشود و آخرین تحولات در ساختار و کارایی اجزای باتری آهن هوا را نشان میدهد؛ این اجزا شامل: الکترود اکسیژن الکترود آهن، ترکیب الکترولیت، جدا کنندهها و طراحی سلول الکتروشیمیایی هستند.
نکات جالب در مورد باتری آهن هوا در مورد ذخیرۀ انرژی
بر خلاف فلز روی در باتریهای روی -هوا، آهن تمایل کمتری به تشکیل دندریت در الکترولیتهای آبی دارد [9] همچنین در مقایسه با باتری آهن-نیکل، با تغییر الکترود مثبت نیکل با یک الکترود هوا، وزن باتری را میتوان به یک سوم کاهش داد. این امر میتواند انرژی مخصوص باتری را تا 100٪ افزایش دهد. آهن بسیار ارزان است و یک منبع سازگار با محیط زیست است. اگرچه الکترولیت قلیایی قوی به وسایل محافظتی مخصوص به خود و همچنین روشهای ایمنی نیاز دارد.
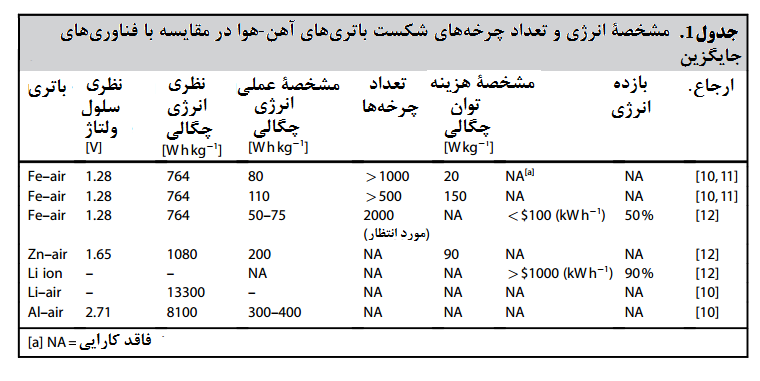
در جدول 1 [10-12] ویژگیهای عملکردی سه نوع باتری آهن هوا را در مقایسه با باتریهای روی-هوا و باتریهای لیتیوم-یونی آورده است. اولین باتری آهن هوا ذکر شده در جدول 1 یک سلول تولید شده توسط یک شرکت تولید سوئدی است که به میزان کارایی قابل قبولی دست یافته است.
وستینگهاوس موفق به ساخت یک سلول با چگالی انرژی بیشتر و توان ویژه بالا ولی به قیمت کاهش چرخۀ عمر باتری، شد. آخرین باتری آهن هوا ذکر شده در جدول1 همان باتری است که نارایان و همکاران[1] در کار پژوهشی خود به آن پرداخته اند. [12]
باتری روی-هوا یک باتری تجاری مفید است که توسط شرکت “سوخت الکتریک[2]” تولید شده است که به لطف چگالی انرژی بالایی که دارد برای استفاده در وسایل نقلیۀ بزرگ مناسب است و رقیب اصلی باتری آهن هوا برای استفاده در وسایل نقلیۀ برقی است.[13]
از جمله مزایای باتری آهن هوا چگالی انرژی متوسط آن است که برابر است با و هزینۀ آن که زیر 100 دلار به ازای هر است. [12] اگرچه پیش از شروع کاربرد تجاری این فناوری، میبایست کارایی و چرخۀ عمر آن بهبود یابد.
وزارت انرژی ایالات متحده پیشنهاد کرده است که یک باتری قابل اطمینان میبایست بتواند حداکثر 5000 بار چرخۀ شارژ – تخلیه را طی کند. و 80٪ کارایی داشته باشد. [14] در حال حاضر چرخۀ عمر پیشرفتهترین باتری آهن هوا 2000 مرتبه شارژ و تخلیه میشود و کارایی آن حدود 50 درصد است. [12]
الکترولیت های اسیدی و قلیایی
باتری آهن هوا معمولاً از یک الکترولیت قلیایی مانند KOH استفاده میکنند، که رسانایی الکتریکی بسیار بالایی دارد و خیلی هم خورندۀ الکترود آهن نیست. خاصیت انحلال پذیری کم محصولاتی همچون برای جلوگیری از تشکیل دندریت (دندانه) مفید است (در عوض دندریتهای آهنی در محیطهای اسیدی شکل میگیرند که درآنها میزان انحلال پذیری انواع آهن بیشتر است).
[15]در مورد الکترولیتهای اسیدی اطلاعات کمی در دسترس هست، اما اگر از هوایی که وارد الکترود میشود خارج نشود، استفاده از آنها میتواند به توقف روند کربنیزه شدن الکترولیت کمک کند.
یک مؤسسۀ ثبت اختراع ژاپنی استفاده از الکترولیتهای اسیدی را پیشنهاد میکند و ادعا میکند که میزان رسوب کربنات را جهت تثبیت چرخۀ شارژ و تخلیه به صفر رسانده است. [16]
یک ثبت اختراع دیگر ژاپنی [17] استفاده از محصولات ژلاتینی حاوی ترکیبات کتون را پیشنهاد میکند که دارای ظرفیت تخلیۀ شارژ بالا و همچنین ولتاژ مدار-باز خوبی هستند.
گزارش شده است که باتری آهن هوا با دمای بالا از نانوذرات مخلوط با الکترود در دمای استفاده میکنند.
این باتری از الکترودهای پربازدهی استفاده میکند که مشخصۀ تخلیۀ انرژی آنان برابر با 91.0% حداکثر مقدار نظری و یک بازده رفت و برگشت برابر با 82.5% است.[18]
ویژگیهای مهم سلول جریان آهن-هوا
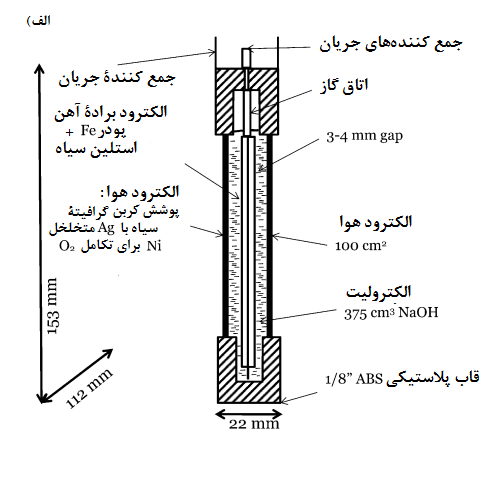
باتری آهن هوا معمولاً شامل یک الکترود آهن با دو الکترود تنفس هوا در هر طرف است که به شکل صفحاتی موازی و مسطح پیکربندی شدهاند.
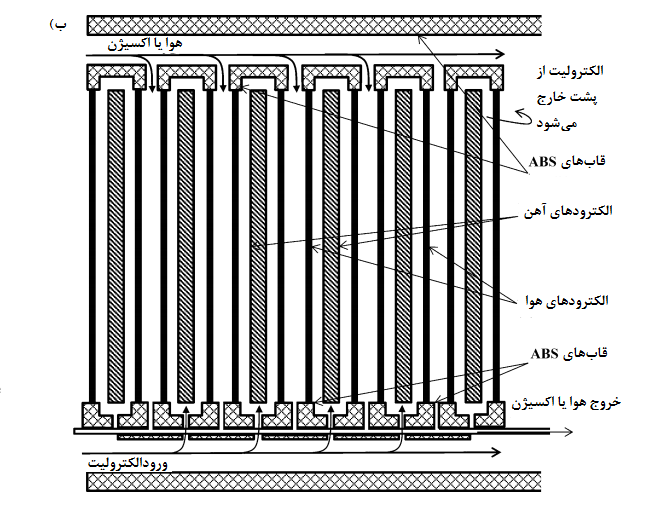
شکل 3-الف) یک سلول تک واحدی را نشان میدهد در حالی که شکل 3-ب) یک پیکربندی شش سلولی را نشان میدهد. [19]
الکترودهای هوای به کار رفته در باتری آهن هوا قابل شارژ طوری طراحی شدهاند که در چرخههای شارژ و تخلیه به ترتیب هم به واکنش تکامل و هم کاهش اکسیژن دست یابند.
در دسترس بودن یک الکترود از جنسی که در طول واکنش تکامل اکسیژن، قادر به مقاومت در برابر پتانسیلهای مثبت بالایی باشد یکی از محدودیتهای ارتقاء باتریهای فلزی – هوایی مورد استفاده است.
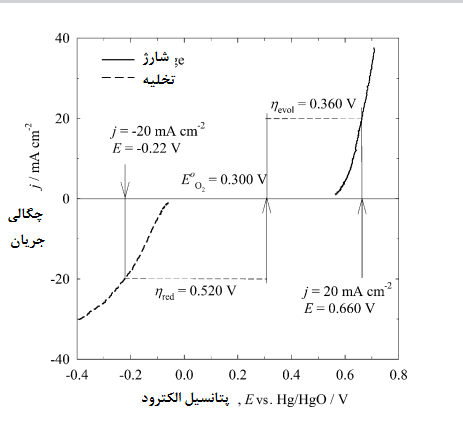
الکترود باید در پتانسیلهای مثبت بالا، از نظر الکتروشیمیایی پایدار باشد و در عین حال با حداقل تلفات در پتانسیلهای مازاد[3]، قادر به کاتالیز واکنشهای کاهش و تکامل اکسیژن باشد. در شکل 4 برای یک الکترود دو کارۀ کبالت و اکسید نیکل بر روی کربن در طول چرخههای شارژ و تخلیه در الکترولیت در دمای مقایسهای از منحنی جریان با پتانسیل آمده است. [20]
پتانسیل تعادلی[4] پیش بینی شده برای اکسیژن در برابر Hg/HgO حدود 0.3 V است و مقادیر واقعی پتانسیل الکترودی که در آن واکنشهای کاهش و تکامل رخ می دهند هنگامی که چگالی جریان برابر با باشد، به ترتیب در مقابل Hg/HgO برابر با 0.22 و 0.66 هستند.
شکل3. سلول آهن-هوا: الف) برش از روبروی یک سلول (پس از Cnobloch) [19] و ب) بسته بندی از شش واحد سلول آهن-هوا [19]
شکل 4. منحنیهای جریان در مقایسه با پتانسیل چرخههای شارژ- تخلیۀ یک الکترود دو کارۀ
کبالت-اکسید نیکل بر روی کربن در الکترولیت در دمای . [20] خط تیرههای افقی نشان دهندۀ مقدار اورپتانسیل مورد نیاز برای کاهش و تکامل اکسیژن با چگالی جریانی برابر با است.
مقادیر اورپتانسیل برابر با 0.52 V برای واکنش کاهش و 0.36 V برای واکنش تکامل هستند. این تفاوتهای زیاد با مقدار برگشت پذیر نشان میدهد که یافتن کاتالیزگری که بتواند این اورپتانسیل را کاهش دهد، چقدر میتواند چالش برانگیز باشد.
در برخی موارد، گزارش شده است که واکنش تکامل اکسیژن را می توان با یک الکترود جداگانه نیز انجام داد. هرچند، این کار حجم و پیچیدگی مخزن سلولی[5] را افزایش خواهد داد. [19]
برای جبران سرعت پایین واکنش کاهش اکسیژن، برای هر الکترود آهن از دو الکترود تنفس هوا استفاده میشود. در یک سیستم معمولی، برای تأمین هوای مورد نیاز الکترود هوا و همچنین زدودن هرگونه کربن دی اکسید موجود در هوای ورودی از یک فن و یک پمپ استفاده می شود.
نرخ جریان الکترولیت آبی و منبع هوا بستگی به نرخ خروج جریان از سلول دارد و باعث از بین رفتن گرمای تولید شده در حین چرخۀ شارژ -تخلیه میشود.
همچنین برای تسهیل تهویۀ الکترولیت، مدار الکترولیت نیز از میان یک مبدل حرارتی و تصفیه کننده عبور میکند. توضیحات دقیق درمورد اجزاء و فرایند تولید الکترودهای تنفس هوای به کار رفته در ساختار نمونههای اولیۀ سلولهای آهن-هوای تولید شده در دهۀ 1970 [6–1] را نیز میتوان در مقالات یافت اما هیچ توضیحی در مورد کاربرد میدانهای جریان برای توزیع هوا در الکترود متخلخل تنفس هوا وجود ندارد.
دراین نمونههای اولیه برای جلوگیری از کربناسیون الکترولیت، مخلوطی از گازهای اکسیژن و نیتروژن درون سلول در داخل یک محفظه (اتاقک) اکریلیک که روی هر الکترود هوا نصب شده بود در بالا و درون یک قاب پلیمری(ABS) استایرن – بوتادین-اکریلونیتریل سوار شده بود به کار رفت.
الکترودها و واکنشهای سلولی
شکل 1 یک سلول آهن -هوا با غشای آنیونی را نشان میدهد و فرایندهای اصلی که طی الف) شارژ و ب) تخلیه رخ میدهد را در قالب شکل بیان میکند. رایجترین روش استفاده از یک الکترود آهن منفی است که باعث تغییرات در مرحلۀ اکسیداسیون آهن از تا و شده و به الکترود اکسیژن مثبت میپیوندد.
در هنگام تخلیه، الکترود بر روی الکترود منفی واکنش داده و در اکسیداسیون فلز آهن به برای تشکیل هیدروکسید مداخله میکند و برخی از نویسندگان[21] پیشنهاد کردهاند که در این فرایند، اکسیداسیون بیشتر نیز به منظور تشکیل به عنوان در یک فرایند پیچیدۀ مربوط به تشکیل آهن مغناطیسی نیز در پتانسیلهای کمتر رخ می دهد.
در واقع واکنشهای الکترود بر روی الکترود آهن به دلیل تبدیل حالت جامد در لایههای سطحی، همگی پیچیده هستند. در هنگام تخلیۀ باتری، فلز آهن آخر سر به آهن مغناطیسی تبدیل میشود و با شارژ شدن مجدد باتری دوباره به شکل فلز آهن درمیآید.
در مورد مکانیسم واقعی که طی آن این فرایند اتفاق میافتد، تصور میشود که چندین مرحلۀ میانی در میان این دو مرحلۀ اصلی شارژ – تخلیه وجود دارد، که هنوز مورد بحث و گمانهزنی هستند. واکنش های الکترود به صورت زیر خواهند بود [22-24].
که در فرمولهای بالا SHE همان الکترود هیدروژن استاندارد است. در الکترود مثبت، کاهش اکسیژن در یک الکترولیت قلیایی در واکنش (3) آمده است:
بنابراین ساده شده ترین واکنش سلولی سراسری که در باتری رخ میدهد را میتوان با توجه به واکنشهای (1) و (2) به شکل [فرمول (4)] نوشت:
در 298 k پتانسیل استاندارد سلول برای واکنش (4) از 1.16 تا 1.28 V بسته به انرژی آزاد گیبس از تا متغیر است. چگالی ویژه انرژی پیش بینی شده برای بر اساس واکنش (1) حدود است و اگر واکنش (4) را در نظر بگیریم شاید این مقدارکمی افزایش یابد.
عملاً شاخص چگالی انرژی تقریباً درجۀ کمی از خاصیت آهن مغناطیسی را داراست چیزی حدود که به دلیل دخالت چندین عامل از جمله اجزای سلول، عدم بازدهی، اورپتانسیل و تخلیۀ محصولاتی که باعث افزایش جرم سلول میشوند، این خاصیت را به خود گرفته است.
این موضوع در بخش “کارایی” با شرح و جزئیات کامل مورد بررسی قرار خواهد گرفت. باور بر آن است که واکنش الکترود آهن (1) به وسیلۀ یک واسطه جذب سطحی ، که به ساده میشود، رخ میدهد، یک نوع محلول آن برای تولید روی سطح الکترود با واکنش میدهد. [23 , 22]
هنگام شارژ مجدد باتری، واکنش کاهش دوم که در واقع عکس واکنش (2) را نشان میدهد، باید با واکنش جانبی تکامل هیدروژن رقابت کند. [واکنش(5)]:
تکامل هیدروژن باعث کاهش راندمان شارژ میشود به طوری که الکترود برای آن که به ظرفیت کامل برسد باید بیش از حد شارژ شود. [25] و هنگام تخلیه نیز به خاطر مقاومت اهمی حبابهای گاز نزدیک الکترود آهنی باعث کاهش پتانسیل سلول خواهد شد.
افزودن موادی همچون، یا سولفیدهای آلیفاتیک به الکترود آهن برای افزایش بازدهی شارژ پیشنهاد میشود.
باور بر آن است که ترکیبات سولفید با کاهش تأثیر روکش آهن بر رسانایی الکترود آهن اثر میگذارند و حتی ممکن است باعث افزایش تخلخل و منافذ پودر آهن شده و باعث تجزیۀ سریعتر لایۀ غیرفعال (روکش) شود.[26] در مورد سولفیدهای آلیفاتیک دسترسی به سطح الکترود محدود شده، که این امر سرعت تکامل جانبی هیدروژن را کاهش میدهد. [27]
حین تخلیه واکنش الکترود هوا، اکسیژن محلول در الکترود را به یا تبدیل میکند و حین شارژ مجدد از این گونههای الکترولیت و ، تولید میکند. بنابراین برای داشتن یک باتری آهن – هوای فرعی، باید الکترود هوا دو کاره باشد؛ یعنی هم کاتالیزگر واکنش کاهش اکسیژن (ORR) و هم واکنش تکامل اکسیژن (OER) باشد. به علاوه باید با یک لایۀ انتشار گاز (GDL) نیز مخلوط شود تا اکسیژن را به سطح الکترولیت/الکتروکاتالیست برساند.
عملاً کاتالیست های دوکاره با اورپتانسیل کم کمتر از هم برای کاهش اکسیژن و هم تکامل اکسیژن نادر هستند و اغلب حاوی فلزات گرانبهایی همچون Pt ، Pd ، Ru و Ir هستند. [2] با این حال، اکثر محققانی که با الکترودهای دو کاره کار میکنند، از فلزات ارزان استفاده کرده و اغلب از دو الکتروکاتالیست برای جداسازی واکنشهای کاهش و تکامل اکسیژن به ترتیب در پیکربندی همان الکترود مربوطه استفاده میکنند.
روند کاهش اکسیژن در محلول قلیایی واکنش (3)، بسیار کند است و به دلیل تشکیل پراکسید واسطه در طی تغییرات پی در پی دو الکترون میتواند از طریق مسیرهای جایگزین پیشروی کند. واکنشهای (6a) و (6b) [29, 28]:
کاهش مستقیم چهار الکترونی اکسیژن در واکنش (3) نسبت به مسیر واکنشهای دو الکترونی واکنشهای (6a) و (6b) بهتر است زیرا در یک پتانسیل استاندارد مثبتتر اتفاق افتاده و ولتاژ سلول سراسری مثبتتری به دست می دهد. علاوه بر این، پراکسید تشکیل شده از کاهش دو الکترونی، واکنشی بوده و به روند خوردگی و تخریب اجزا سلول سرعت میبخشد. [30]
به طور کلی، مسیر چهار الکترونه در فلزات گروه پلاتین (Pt ، Pd و Ni) ، نقره و اکسید فلزات خاصی مانند اسپینل (اکسید آلومینیم)، پروسکایت و پیروکلر محبوبتر است. [31] مسیر پراکسید دو الکترونه برای مواد کربنی (از جمله گرافیت)، طلا و بیشتر اکسیدهای فلزات گروه انتقال مناسبتر است.[32]
گمان میرود که برخی اکسیدها همچون به یک واکنش شبه چهار الکترونه پاسخ دهند از آنجا که در تجزیۀ پراکسید مانند واکنش (6b) یک کاتالیست قوی است، این واکنش آنقدر سریع رخ میدهد که به نظر میرسد چهار الکترون به طور همزمان منتقل شدهاند. [33]
هنگام شارژ مجدد، واکنش معکوس رخ میدهد و اکسیژن نیز در فرایند انتقال چهار الکترونه حظور دارد که ممکن است همزمان باعث آزاد شدن دو اتم اکسیژن متناسب با یک اتم فلز روی سطح الکترود گردد. [34] فعالترین کاتالیست ها برای این واکنش و هستند اما این فلزات بسیار گران قیمت هستند و به همین دلیل کاتالیست های دیگری از جنس اکسیدهای فلزی و ترکیبات آنان در حال ساخت هستند.
تفاوت میان باتریهای آهن-هوا و سایر باتریهای فلز-هوا
الکترود آهن در سلول آهن -هوا در طول فرآیند آبکاری فلز، تولید دندریت (دندانه) نخواهد کرد از آنجا که واکنشهای الکتروشیمیایی شامل تغییرات فاز جامد نیز هستند، اما به دلیل تشکیل گونه های حجیم و نامحلول و که چگالی آنها با فلز Fe متفاوت است ممکن است شکل و حجم الکترود در حین چرخههای شارژ و تخلیه تغییر کند. همچنین این احتمال نیز وجود دارد که بخشهایی از الکترود به دلیل پتانسیل نامیزان و توزیع جریان در چرخههای آبکاری و انحلال (تجزیه) غیرفعال شوند.
میتوان ویژگیهای سلول آهن -هوا را به شکل زیر خلاصه کرد:
1) بدون ساخت دندریت یا تغییر شکل کلی الکترود منفی (برخلاف باتری های روی-هوا).
2) سلول آهن-هوا نسبت به سلول روی-هوا ولتاژ پیش بینی شدۀ کمتری دارد (1.28 در مقایسه با 1.65V) اما راحتتر شارژ میشود.
3) عمر الکترود منفی طولانیتر است.
4) الکترود منفی کمتر از Al یا Li به حفاظت در برابر خوردگی نیاز دارد.
5) سلول آهن-هوا (Fe-air)ایمنتر از سلول لیتیوم-هوا (li-air) است اما از آن سنگینتر است.
6) سلول آهن-هوا (Fe-air)برخلاف سلول روی-هوا (Zn-air) دارای لایههای سطحی پیچیدهای است، برخلاف سلول روی-هوا، که معمولاً روند انحلال روی به شکل یونهای زینکات در محلول، برگشت پذیر است.
الکترود منفی (آهن)
به دلیل واکنش فرعی تکامل هیدروژن که آب را به گونهای استفاده میکند که الکترودها ناچاراً باید بیش از حد شارژ شوند تا به ظرفیت کامل خود برسند؛ راندمان (بازدهی) شارژ الکترود آهن، پایین است. [35] یکی دیگر از مشکلات الکترود آهن نرخ تخلیۀ پایین آن در نتیجۀ تشکیل یک عایق الکتریکی به نام هیدروکسید است که در نرخهای تخلیۀ بالا، باعث کاهش ولتاژ سلول میشود. [36-39]
الکترودهای آهن معمولاً از مواد پودری ساخته میشوند که شامل آهن فلزی یا اکسیدهای آهن هستند و رایجترین آنها است. از این پودرها میتوان برای تقویت مواد رسانایی همچون کربن، جهت ارتقاء و افزایش مساحت سطح فعال و رسانایی آنان استفاده نمود.
چالشهای اصلی در تولید یک الکترود آهن
چالشهای اصلی در تولید یک الکترود آهن مناسب برای ساخت یک باتری آهن -هوا عبارتند از:
1) افزایش استفاده از مواد آهنی
2) جلوگیری از غیرفعال شدن آهن (زنگ زدگی)
و 3) کاهش تکامل هیدروژن در سطح الکترود در هنگام شارژ
بهترین راهکار برای حل مشکل بهرهبرداری اندک از آهن این است که سعی کنیم با استفاده از ذرات نانوییِ آهن، جهت افزایش مساحت سطح، مقدار بیشتری از الکترود جامد را در مجاورت الکترولیت قرار دهیم. اخیراً یک سری مطالعات بر روی الکترودهای آهنی نانوساختار انجام شده است که نشان داده است ظرفیت شارژ این الکترودها در مقایسه با الکترودهای پودری فلز-جیبی افزایش یافته است.
جدول 2 نتایج بدست آمده از این الکترودها را خلاصهوار بیان میکند.
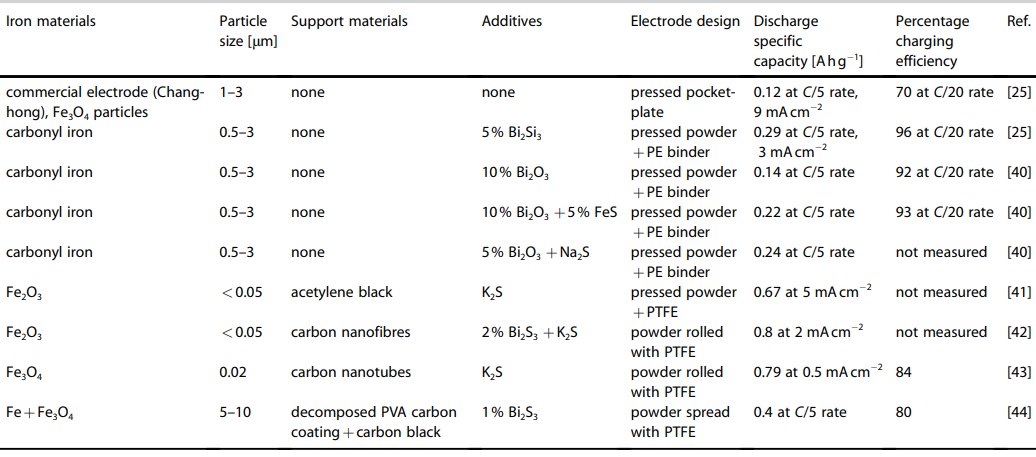
جدول 2- ویژگی های الکترود اهن استفاده شده برای سلول آهن-هوا در دمای 298 کلوین
در مورد الکترودهای آهن-کربونیل تولید شده توسط مانوهار و همکاران[6] [25,40] کشف شد که خلوص بالای آهن-کربونیل باعث افزایش ظرفیت ویژه تخلیه میشود حتی با این وجود که اندازۀ ذرات آن خیلی هم از الکترودهای بازاری تولید شده توسط شرکت چانگهونگ الکتریک[7] (جدول 2) کوچکت تر نبود.
ظرفیت های ویژه تخلیه در جدول 2 [25,40 , 41-44] بر حسب نرخ تخلیۀ C/5 مقایسه میشوند (که در آن C ظرفیت شارژ کامل الکترود) است که توسط شرکت باتریسازی سیچوان چانچونگ[8] برای عملکرد باتریهای Ni -Fe ساخت خود شرکت پیشنهاد شدهاست.
در این مطالعات برای کاهش سرعت تکامل هیدروژن و افزایش بازده شارژ الکترود انواع ترکیبات از جمله ، ، و به الکترود آهن افزوده شد.
در نرخ تخلیۀ C/5 ، با افزودن5 % wt بهترین نتایج هم از نظر ظرفیت و هم از نظر بازدهی بدست آمدند؛ اگرچه مشخص شد که در نرخهای بالاتر تخلیۀ C/1، الکترودها با افزودن حجم بیشتری از ظرفیت خود را حفظ کرده و عملکردی به خوبی همان الکترود داشتند.
نویسندگان ادعا کردهاند که مشتقات سولفید با تشکیل یک لایه رسانای در واکنش با اتمهای سطحی آهن که لایۀ عایق ناشی از زنگزدگی را بی اثر میکند، اثر مخرب پدیدۀ زنگ آهن بر ظرفیت الکترود را کاهش میدهند. [40]
استفاده از افزودنی به تنهایی ظرفیت الکترودهای آهن را چندان افزایش نداد بنابراین این موضوع نشان میدهد که اتمهای گوگرد اهمیت بیشتری نسبت به حضور بیسموت به تنهایی دارند. سایر الکترودهای آهنی (جدول 2) اخیر، نشان داده اند که هنگامی که از نانوذرات اکسید آهن بر روی کربن رسانا استفاده شد، ظرفیت تخلیۀ بیشتری بدست آمده است.
الکترودهای نانو لولهای پر شده با نانوفیبر کربنی توسط ایتو و همکاران[9] اختراع شدند. و گزارش شده است که هانگ و همکاران[10] به ظرفیت ویژهای برابر با و بازدهی چرخۀ 76% در چرخۀ 30 ام دست یافتند. [42،43] به نظر میرسد که اندازۀ کوچک و سطح وسیع، ( بزرگتر از ) نانو ذرات تقویتی بر روی کربن کریستالی رسانا و نانولولههای کربنی محتمل ترین عواملی هستند که در افزایش ظرفیت آنها نقش داشته اند.
اندازه گیریهای TEM و XRDنشان دادهاند که ذرات نانوسایز به خوبی توزیع شده و با استحکام کافی به نانوفیبرهای کربنی لوله ای متصل شده اند. به عنوان یک افزودنی به الکترولیت قلیایی اضافه شده بود، اما به نظر میرسد که افزوده بر الکترولیت به عنوان مکانیزمی برای افزایش بازدهی شارژ نسبت به مواد افزودنی جامدی همچون و اثر بخشی کمتری دارد.[25،40]
گمان میرود که یونهای سولفید برای تولید در سطح الکترود با واکنش داده باشند، [40] اما شاید این آنقدری که میبایست، یکنواخت توزیع و پراکنده نشده باشد یا اینکه به اندازۀ جامدی که مستقیماً در پودر الکترود ترکیب میشود، الکترواکتیو[11] نباشد.
برای نتیجهگیری از این بخش، می توان اینگونه بیان کرد که اهمیت اندازه ذرات بیشتر از اهمیت منبع آهن مورد استفاده به عنوان آند (فلزی یا اکسید فلز) است. این موضوع در جدول 2 نیز اثبات شده است که هرچه ذرات حاوی آهن کوچکتر باشند، ظرفیت تخلیۀ مشاهده شده نیز بیشتر خواهد بود.
اگر چه تعداد الکترودهای آهن گزارش شده در متن برای نتیجه گیری قطعی در مورد تأثیر اندازۀ ذرات، بسیار کم است؛ ممکن است عوامل دیگری هم در این موضوع دخیل باشد (مانند ریخت شناسی ذرات و ماهیت مواد تقویتی و افزودنیها) افزودن سولفید بیسموت یا اکسید بیسموت به سولفید آهن در افزایش بازدهی شارژ الکترود آهن بسیار مؤثر است، اگرچه تأثیر مقادیری از بیشتر از 5 % wt ناشناخته است، زیرا در ساختار همۀ الکترودها از مقادیر کمتر از
5 % wt استفاده شده است.
جایگزینی که به تازگی برای استفاده از یا پیشنهاد شده است، محافظت از سطح الکترود به وسیلۀ یک تک لایۀ[12] خود-ساخته از تیولهای آلکان است که برای n-hexanethiol روی یک الکترود کربونیل آهن دارای بازده شارژ 92 ٪ است [27]
از مزیای این جایگزین میتوان به هزینۀ کمتر آن و قابلیت بازیافت بهتر آن نسبت به ترکیبات بیسموت اشاره کرد، اما تأثیر آن بر ظرفیت الکترود و قابلیت خیس شدن[13] آن هنوز هم جای بهتر شدن دارند.
الکترود مثبت (هوا)
برای داشتن یک باتری آهن-هوا، قابل شارژ، باید یک الکترود هوای دو کاره پیدا کرد که بتواند به طور مؤثر هم ORR و هم OER را کاتالیز کند. برای افزایش فعالیت کاتالیزوری، مساحت سطح زیاد امری ضروری است. اگرچه، هم کاتالیزور و هم مواد نگهدارنده (تقویت کننده) باید در برابر اثر خورندگی یک محلول قلیایی قوی (معمولاً ) بسیار مقاوم باشند.
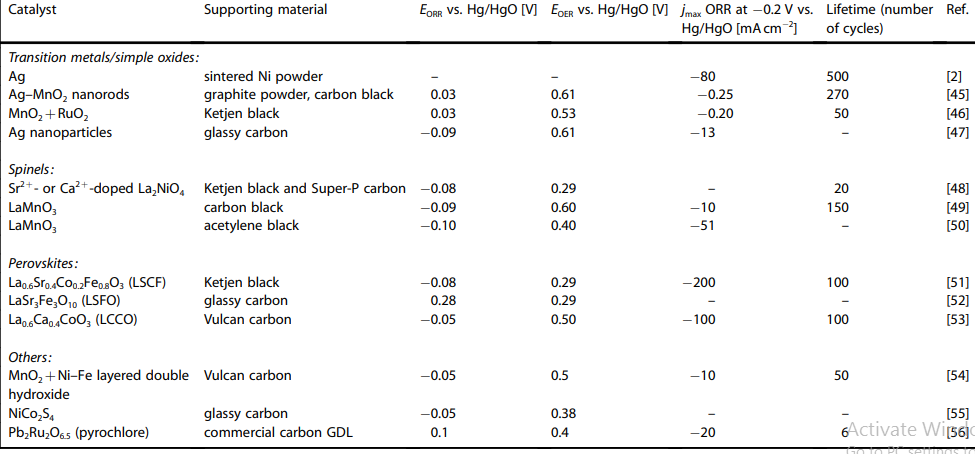
به تازگی، یک سری جایگزین برای کاتالیست های گران قیمت پیشین Pt ، Pd (ORR) و و آلیاژهای آنان در نظر گرفته شده است. به نظر میرسد اکسیدهای فلزی ترکیبی، مانند پروسکیتها ، اسپینلها و پیروکلرها مسیر کاهش چهار الکترودی اکسیژن را ارتقا داده و فعالیت کاتالیزوری خوبی را هم برای ORR و هم OER رقم بزنند. از آنجا که آنها نیمه رسانا یا عایق هستند، باید با یک مادۀ رسانای متخلخل تقویت گردند، جدول 3 [2،45-56] خلاصه ای از خواص الکتروشیمیایی برخی از کاتالیزورها را ارائه میدهد که گزارش شده فعالیتهای دوسویه ای هم در جهت کاهش اکسیژن و هم تکامل آن دارند.
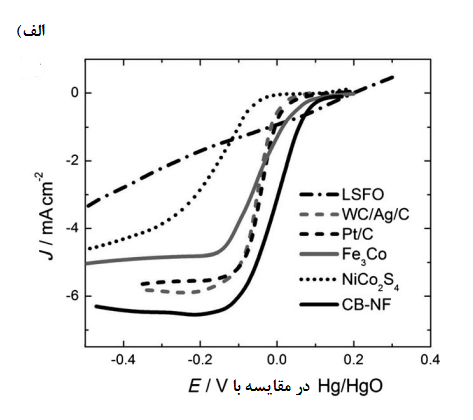
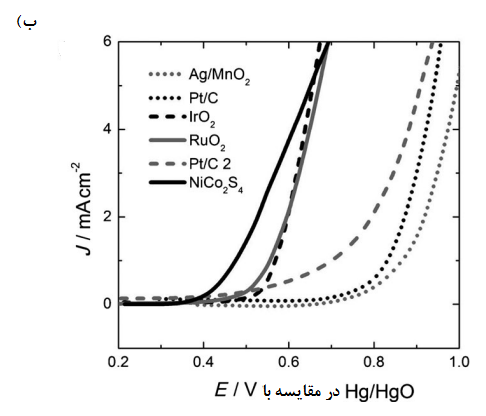
گزارش شده است که بیشتر کاتالیست های اکسیژن تنها فعالیت زیادی در زمینههای ORR یا OER دارند. در شکلهای 5 و 6 منحنیهای جریان در مقایسه با پتانسیل برای برخی کاتالیست های دو کاره که به طور مختصر در جدول 3 آمده بود ارائه شده است که حاوی دادههایی در مورد فعال ترین کاتالیست های فلزات نجیب (Pt/C) برای ORR [57] و و برای OER و همچنین برخی کاتالیست های دیگر، مانند [58] و کربن سیاه دوپ شده با نیتروژن و فلورین، [59] که به گزارش پژوهشگران عملکردی قوی تنها برای ORR یا OER دارند. شکل 5 نتایج کاهش اکسیژن حاصل را برای الکترودهای هوای انتشار گاز کامل[14] نشان میدهد در حالی که شکل 6 نتایج را هم برای کاهش و هم تکامل اکسیژن نشان میدهد که از کاتالیزوری چسبیده به سطح الکترود دیسک گردان[15] در یک محلول اکسیژن اشباع شده بدست آمده است.
نتایج به دست امده از جدول 3 و شکلهای 5 و 6 نشان میدهند که اسپینلها یا پروسکایتها دارای کمترین میزان اورپتانسیل برای کاهش اکسیژن هستند. بهویژه، پروسکایت هنگامی که بر روی یک الکترود دیسک گردان کربنی شیشه ای تقویت شده، یک عملکرد دو منظورۀ امیدوار کننده با اورپتانسیلهای بسیار کم برای واکنشهای کاهش و تکامل اکسیژن (شکل 6 الف)[52]. از خود نشان داد.
جدول 3 ویژگی های کاتالیست های دوکاره های که اخیرا مورد استفاده قرار گرفته اند
شکل 5. منحنیهای چگالی جریان در مقایسه با پتانسیل الکترود برای کاهش اکسیژن در الکترودهای انتشار گاز (GDEها) در محلولهای قلیایی غلیظ. CB = کربن سیاه تصفیه نشده [49] – Ag NP = نانوذرات اکسید 10 [47] روی کربن سیاه- [49] – روی استیلین سیاه (نرخ اسکن مجهول)- [53]Pt/C = Pt تجاری (بازاری) بر روی کربن GDE تولید شده توسط جانسون متی[16] ، در [57] الکترولیت در دمای برابر با محلول KOH بود، بجز [50] که در دمای برابر با KOH بود.
از کاتالیزورهای آزمایش شده بر روی یک الکترود انتشار گاز پیشرفته (شکل 5) ، پروسکیتها LCCO و هر دو در مقایسه با الکترود بازاری Pt/C به ORR بالایی دست یافتند. [50،53] پروسکایت ها شاملLSCF و اسپینل دوپ شده با نیز برای OER اورپتانسیلهای بسیار کمی را ارائه میدهند ( ) ، و همچنین کاتالیزورهای خوبی برایORR هستند [48،51] پیروکلرها از جمله ، دارای ویژگیهای دو منظورۀ بسیار خوبی هستند (جدول 3) اما هنگام تکرار چرخه در پتانسیل های منفی، پایداری بسیار ضعیفی از خود نشان می دهند [56] و با محدودیتهای زیست محیطی و منابع روبرو هستند، زیرا حاوی فلزاتی گرانبها و سمی هستند.
شکل 6. منحنیهای چگالی جریان در مقایسه با پتانسیل برای: الف) کاهش اکسیژن و ب) تکامل اکسیژن در الکترودهای دیسک گردان که با کاتالیزورهای مختلفی در محلول KOH در دمای اتاق روکش شدهاند. برچسب ها درشکل (الف) به معنای زیر هستند: [52] WC/Ag/C = کربید تنگستن با نقره بر روی کربن [77] Pt/C = پلاتین بر روی کربن ؛ [55] سیاه دوپ شده با نیتروژن و فلورین. [59] برچسب های (ب) اشاره می کنند [55] و CB-NF= کربن سیاه دوپینگ شده با نیتروژن و فلورین [59] برچسبها در شکل ب) به معنای [45]، Pt/C[42]، و [78]Pt/C2 [55] و [55]
در جستجوی کاتالیزورهای جدید برای کاهش و تکامل اکسیژن باید بر طبیعت واکنشهای پیوند سطحی با O2 و افزایش فعالیت کاتالیزوری آنها تمرکز شود. [60] به عنوان مثال با آلیاژسازی فلز پلاتین با سایر فلزات، انرژی نوار ظرفیت[17] d انواع پلاتین را میتوان با فلز آلیاژی انتقال داد، که باعث ایجاد برهمکنشهای متقابل پیوندی و غیر پیوندی قویتر یا ضعیفتری با مولکول خواهد شد.
به ویژه، اثبات شده است که قابلیت پیوند در آلیاژهای PtPd (111) و Pt3Ni (111) افزایش یافته است
[61 ، 62].کاهش اکسیژن روی ترکیبات پروسکیت در ابتدا از طریق مسیر پراکسید پیشمیرود اما پروسکیت، واسطۀ پراکسید را از طریق پیوند حفظ میکند تا بعداً بتوان آن را کاهش داد، پس واکنش منجر به یک فرایند آشکار میشود که کارآمدتر از مکانیسم کاهش است که تنها را آزاد میکند و اغلب روی سایر اکسیدهای فلز های -گذار رخ میدهد. [63]
همچنین ساختار یک پروسکیت آن را قادر میسازد OER را به خوبی کاتالیز کند: یک پژوهش که به تازگی بر صورت گرفته و در آن Ln یک فلز لانتانید است، بر اهمیت نزدیک بودن انرژی نوار p اکسیژن به سطح پروسکیت در افزایش سرعت تکامل تأکید داشته است. مشخص شد که اختلاف انرژی نباید کمتر از 1.75 eV باشد، در غیر این صورت اکسید پیش از OER بی ثبات خواهد شد. [64]
در بیشتر موارد، کاتالیزورهای دوکارۀ اکسیژن رسانایی الکتریکی محدودی دارند بنابراین حظور یک مادۀ نگهدارنده (تقویت کننده) که کاتالیزور با آن پیوند شیمیایی برقرار کرده یا ترکیب فیزیکی گردد ضروری است.
کربن سیاه، مانند کتژن سیاه، استیلن سیاه و ولکان، گزینههای محبوب مواد نگهدارندۀ کاتالیزور هستند زیرا آنها از یک مساحت سطح بالا و رسانایی بالا و معقول برخوردارند (سطح Vulcan XC72 در حدود و رسانایی آن حدود [65] است. گاهی اوقات نیز ممکن است از سایر پودرهای رسانا، ازجمله پودر Ni و Ebonex، استفاده شود؛ اگرچه این پودرها معمولاً نسبت به کربن سیاه مساحت سطح بسیار کمتری دارند؛ اما مقاومت آنها در برابر خوردگی در محلول قلیایی در پتانسیلهای بالاتر بسیار بیشتر است ]66و67[.
جنس الکترود و طراحی سلول
برای استفادۀ بهینه از مواد فعال (نانوذرات آهن، کاتالیزور دو کارۀ اکسیژن) که در بالا توضیح داده شد، الکترودها باید به خوبی طراحی شده باشند. در مورد الکترود آهن، سطح آهنی که با الکترولیت در تماس است، باید تا حد ممکن بزرگ باشد تا در هنگام تخلیۀ سلولی حداکثر بهرهبرداری را از مواد فعال حاوی آهن داشته باشیم (همانطور که در واکنش (1) نیز مشاهده شد).
به عنوان مثال، مادۀ نگهدارندۀ (تقویت کنندۀ) نانوفیبر کربنی در منبع [42] دارای مساحت سطحی برابر با بوده و با ذرات کوچک تر از نانومتر تزئین شده بود. که هر دوی این عوامل در ظرفیت تخلیۀ بسیار بالای تولید شده از این دو الکترود (چیزی حدود ) نقش ویژهای داشتند.
همانطور که در جدول نیز 2 توضیح داده شد، بهترین الکترودهای آهن از نظر کارایی، از نانوپودر اکسید آهن تشکیل شده اند که به خوبی بر روی یک بستر رسانا مانند کربن پراکنده شده اند. این زیرلایۀ رسانا کمک میکند تا مشکل غیرفعال شدن الکترود آهن (توسط زنگ زدگی) را دور بزنید، در زنگزدگی، تجمع اکسیدهای آهن (که عایق الکتریکی هستند) بر سطح نانوذرات آهن، باعث کاهش رسانایی ذرات آهن میشود. [69] کربن مادۀ خوبی برای ایفای این نقش است؛ زیرا چگالی آن بسیار کمتر از آهن بوده و تنها بخش کمی از وزن کلی الکترود را به خود اختصاص میدهد. (سبک است)
برای دستیابی به چگالی انرژی حجمی بیشتر میتوان با انباشته کردن چند لایه آهن به شکل چندین ورق مسطح آهنی در الکترود، یک الکترود آهنی سه بعدی ساخت. که این به معنای یک سری الزامات در طراحی الکترود آهن است: از آنجا که کل مواد فعال در سطح الکترود حضور ندارند، الکترود میبایست متخلخل[18] و آب دوست[19] باشد، تا اجازه دهد جرم کافی از از الکترولیت به داخل الکترود منتقل گردد.
برای ساخت یک الکترود متخلخل سه بعدی، چندین روش وجود دارد: میتوان یک گلوله از مواد پودر آهن تقویت شده با کربن را با یک اتصال دهنده، مانند PTFE یا Nafion، با حرارت به هم پرس کرده و به یک جمع کنندۀ جریان فلزی متصل کرد. این رایجترین روش مورد استفاده برای کل الکترودهای آهنی است که در جدول 2 آمده بودند.
یک روش جایگزین نیز بارگذاری پودر آهن درون یک مادۀ سه بعدی بسیار متخلخل مانند نمد کربن [20]یا فوم کربن[21] است اگرچه تاکنون هیچ مقالهای در مورد الکترودهای آهنی ساخته شده با این تکنیک نوشته نشده است اما این روش میتواند رسانایی و نسبت حجم/مساحت الکترود را افزایش دهد[70] اما یکی از معایب آن افزودن جرم اضافی مواد غیر فعال به الکترود است.
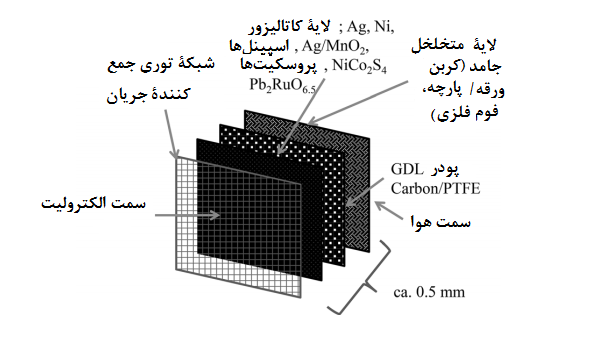
الکترود هوا نسبت به الکترود آهن، طراحی پیچیدهتری دارد، زیرا به یک لایۀ آب دوست و کاتالیزوری در کنارش نیاز دارد که روبروی الکترولیت قرار گیرد ضمن اینکه یک لایۀ آبگریز متخلخل نیز در سمت مقابل داشته باشد که اجازۀ نفوذ به الکترود را به اکسیژن دهد (شکل 9).
شکل9. طراحی احتمالی الکترود هوای انتشار-گاز [19]
لایۀ آبگریز متخلخل که اغلب “لایۀ انتشار گاز[22]” (GDL) نیز نامیده میشود، معمولاً از ترکیب یک پودر رسانای ریز-حفره ای که با PTFE یا یک پلیمر آبگریز مقاوم در برابر قلیاها ترکیب میشود، تشکیل شده است، تا اطمینان حاصل کنیم که منافذ باز GDL در الکترولیت غرق نخواهند شد.
گاز اکسیژن از طریق این منافذ باز، به سمت لایۀ کاتالیزور آب دوست که غرق در الکترولیت است پراکنده میشود. برای بهبود آبگریزی و یکپارچگی ساختاری الکترود نیز میتوان یک لایۀ اضافی به پشت GDL اضافه کرد.
این لایه را میتوان از پارچه/ ورقۀ کربنی، فوم های فلزی، یا PTFE متخلخل تهیه کرد؛ بسته به رسانایی، چگالی، تخلخل و استحکام مکانیکی که مورد نیاز است. [66 ، 71-74]
لایۀ کاتالیزور اغلب از یک پودر کاتالیست که با یک پودر رسانا به هم پرس (فشرده) شدهاند، ساخته می شود. بیشتر اوقات، کربن به دلیل هزینۀ کم و چگالی پایینی که دارد، افزودنی رسانای انتخابی است.
اگرچه، کربن در پتانسیلهای مثبتی که به شدت اکسید کننده هستند، مقاومت ضعیفی در برابر خوردگی دارد. [75] یک مثال جدید دارای یک الکترود هوا است که در آن هم GDL و هم مواد کاتالیست بر پایۀ نیکل بوده اند، به شکل پودر نیکل و فوم نیکل. [66]
نویسندگان درمورد الکترود هوا- نیکل کاتالیز شده با اسپینل خود ثباتی طولانی مدت و خوب را گزارش دادند (در پتانسیلهای شارژ مجدد برابر با در مقایسه با Hg/HgO و یک چگالی جریان بالا چیزی حدود ) در حالت ایده آل، الکترود انتشار گاز باید بسیار نازک تر از الکترود آهن باشد: حدود 0.1 mm یا در صورت امکان نازک تر.
هرچقدرGDL نازکتر باشد، (کاغذ و پارچههای کربنی معمولاً هستند) باعث میشود زمان لازم برای انتشار اکسیژن پیرامون GDL کاهش یابد. یک لایۀ کاتالیزور بسیار نازک به موجود در الکترولیت اجازه میدهد تا هنگام کاهش اکسیژن سریع تر به سمت کاتالیزور پخش شود و هنگام تکامل اکسیژن اجازه میدهد تا حبابهای اکسیژن از کاتالیزور خارج شوند. اثبات شده است که ضخامت کلی الکترود هوا در باتریهای (لیتیوم-هوا Li -air) تأثیر زیادی بر عملکرد سلولها دارد.[76]
طراحی سلول
گزارش شده است که تا به امروز در باتری آهن هوا از پیکربندی معمولی الکترود صفحۀ فلز موازی (که در اکثر راکتورهای الکتروشیمیایی به کار رفته) استفاده شده است.[68] این چیدمان امکان نرخ انتقال جرم بالا و اتلاف گرمای زیاد و همچنین انعطاف پذیری را برای افزایش نسبتاً ثابت راکتور با استفاده از ماژول فراهم می کند. به طور کلی، شکل هندسی الکترودها ابتدا همراه با مسیرهای دنبال شده در نظر گرفته می شود.
[WPSM_AC id=7335]


![منحنیهای چگالی جریان در مقایسه با پتانسیل الکترود برای کاهش اکسیژن در الکترودهای انتشار گاز (GDEها) در محلولهای قلیایی غلیظ. CB = کربن سیاه تصفیه نشده [49] - Ag NP = نانوذرات اکسید 10 [47] روی کربن سیاه-](https://novasi.ir/wp-content/uploads/2021/11/9.png)




تعقیب
[…] باتری آهن هوا […]
دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.