باتری پتاسیم هوا؛ طراحی و چشم انداز آن
باتری پتاسیم هوا
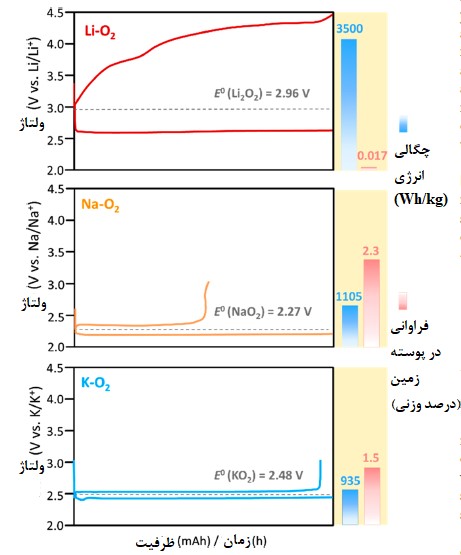
یک سیستم ذخیره انرژی به عنوان یک فاکتور کلیدی برای استفاده گسترده از انرژیهای تجدیدپذیر و توسعه خودروهای برقی (EV) شناخته میشود. باتریهای فلز قلیایی-اکسیژن از جمله باتری پتاسیم هوا که چگالی انرژی وزنی بالاتری (Wh/kg 3500-9350) نسبت به باتریهای متداول لیتیوم-یونی (Wh/kg 100-265) دارند به عنوان نسل جدید و آیندهدار سیستمهای ذخیره انرژی شناخته میشوند.
در دهههای اخیر، باتریهای لیتیم هوا به دلیل داشتن بالاترین چگالی انرژی در کانون توجهات قرار داشته است اما برگشتپذیری ضعیف، راندمان رفت و برگشتی پایین و چرخه محدود عمر آن ها به دلیل سینتیک آهسته و واکنش های جانبی باعث جلوگیری از توسعه باتریهای Li-O2 شده است. برخلاف باتریهای Li-O2، باتریهای پتاسیم هوا با پایه پتاسیم سوپراکسید دارای چگالی انرژی نظری بالایی هستند (Wh/kg 935) و راندمان انرژی و طول عمر بهتری نسبت به سایر باتریهای اکسیژن-فلز قلیایی دارند.
واکنش سریع و برگشتپذیر O2/KO2 سینتیک اکسایش/کاهش بالاتری نسبت به واکنشهای اکسایش/کاهش باتریهای لیتیم هوا دارد که نیاز به کاتالیست یا واسطه برای واکنش اکسایش/کاهش را حذف میکند. علاوه بر این، پتاسیم که به وفور در زمین یافت میشود مشکل توزیع غیریکنواخت و کمبود جهانی لیتیوم را برطرف میکند.
این مزایای باتری پتاسیم هوا آن را به یک گزینه آیندهدار برای ذخیره انرژی در مقیاس بزرگ و با هزینه پایین تبدیل کرده است اما توسعه این باتری هنوز در مراحل اولیه خود است و راندمان رفت و برگشتی آن پایینتر از باتری لیتیوم-یونی است. قبل از کاربرد عملی باتری پتاسیم هوا لازم است که راندمان انرژی و چرخه عمر آنها ارتقا یابد.
در این مقاله سعی داریم تا کارهای انجام شده برای درک بهتر این باتریها را معرفی کنیم و استراتژیهایی را برای طراحی نسل جدید باتریهای K-O2 ارائه دهیم. همچنین اطلاعات خوبی در زمینه بازگشتپذیری و پایداری الکترود اکسیژن، پایدارسازی آند و آندهای جایگزین و طراحی یک سیستم بسته بر اساس تبدیل KO2-K2O2 ارائه میشود.
پنج عامل فیزیکی شیمیایی که روی بازگشتپذیری و پایداری الکترود اکسیژن اثر میگذارند در مقالات موجود بررسی میشوند که این عوامل عبارتند از: طراحی الکترود، مکانیزم رشد، محیط عملیاتی، مکانیزم تجزیه شیمیایی و طراحی فصل مشترک الکترود-الکترولیت. علاوه بر این، توسعه مواد جایگزین آند برای حل مشکل آند پتاسیم بررسی میشود و مزایا و معایب آندهای جایگزین با هم مقایسه میشوند.
همچنین به دلیل عبور اکسیژن به سمت آند و تبخیر الکترولیت در باتریهای چرخه باز پتاسیم هوا، استراتژیهایی برای طراحی سیستمهای بسته معرفی میشوند. در آخر نیز چشمانداز آینده برای درک بهتر واکنش K-O2 و طراحی این باتریها به منظور استفاده عملی آن ها ارائه میشود.
1-مقدمه
باتریهای لیتیوم-یونی به عنوان سیستمهای اصلی ذخیره انرژی برای ماشینهای برقی و وسایل الکترونیکی همراه شناخته میشوند [1] اما چگالی محدود انرژی آن ها و هزینه بالای ساخت این باتریها به دلیل استفاده از فلزات واسطه (مانند Co) باعث شده تا نتوانند نیازهای روزافزون صنعت خودروسازی و سیستمهای ذخیره انرژی در مقیاس بزرگ را برطرف کند.
باتریهای فلز قلیایی-اکسیژن که از اکسیژن پایانناپذیر موجود در هوا بعنوان ماده فعال استفاده میکنند دارای چگالی انرژی ثقلی بالا و هزینه پایینی هستند که این مزایا باعث شده تا به عنوان یک باتری جایگزین شناخته شوند. تحقیقات زیادی روی چگالی انرژی ثقلی بالای باتریهای لیتیوم-اکسیژن با پایه پراکسید تمرکز داشتهاند (Wh/kg 3500، براساس Li2O2) [2,3]، ولی این باتریها راندمان انرژی پایین و چرخه حیات کوتاهی دارند که دلیل آن سینتیک آهسته واکنش Li2O2-اکسیداسیون و واکنشهای پارازیتی شدید ناشی از الکترون یکتایی (1O2) آنها است [2,4-6].
در عوض، باتریهای با پایه سوپراکسید Na-O2 (با چگالی انرژی Wh/kg 1105 بر اساس NaO2) [7] و K-O2 (با چگالی انرژی Wh/kg 935 بر اساس KO2) [8] از طریق واکنش تک الکترونی کار میکنند که نسبت به باتریهای Li-O2 دو الکترونی دارای سینتیک سریعتر و راندمان انرژی بهتری هستند. اما تشکیل NaO2 از لحاظ سینتیکی ترجیح داده میشود چون بصورت خودبخود به Na2O2/Na2O2.2H2O تبدیل میشود که بازگشتپذیری پایین پیلهای سوختی Na-O2 را به همراه دارد [9]. علاوه بر این، تشکیل الکترون تک دانهای (اکسیژن یکتایی) در باتری Na-O2 بعنوان محرک اصلی برای تجزیه شیمیایی باتری شناخته میشود [10].
محصول تشکیل شده حین فرایند تخلیه شارژ باتری پتاسیم هوا نیز از لحاظ سینتیکی مطلوب است و از لحاظ ترمودینامیکی نیز پایدار میباشد [8]. ترکیب ردوکس O2/KO2 باعث میشود تا قطبش (پلاریزاسیون) پایینی داشته باشیم و فرایند تخلیه نیز در ولتاژ کمتر از 3 ولت کامل شود. این در حالیست که K/K+ باعث حداقل شدن تشکیل الکترون تک دانهای و واکنش پارازیتی ناشی از پتانسیل بالا میشود [10]. راندمان رفت و برگشتی بالای باتری پتاسیم هوا (بیشتر از 90 درصد) در غیاب کاتالیست یا ترکیب واسطه واکنش اکسایش/کاهش باعث میشود تا گزینه بهتری نسبت به سایر باتریهای فلز قلیایی-اکسیژن باشند. علاوه بر این، فراوانی پتاسیم در پوسته زمین میتواند بحران کمبود لیتیوم و افزایش قیمت آن را جبران کند. باتری پتاسیم هوا به دلیل مزایایی نظیر راندمان بالای تبدیل انرژی، فراوانی عنصر پتاسیم، هزینه پایین و تولید محدود 1O2 حین چرخه شارژ/دشارژ توجه زیادی را به خود جلب کردهاند (شکل 1) [11-13].
شکل 1 مقایسه پروفایل ولتاژ، چگالی انرژی نظری و فراوانی در پوسته زمین (Li, Na, K) باتریهای فلز قلیایی-اکسیژن. پروفایلهای ولتاژ از مقاله 13 گرفته شدهاند.
علیرغم وجود این مزایا، توسعه باتری پتاسیم هوا همچنان در مراحل اولیه خود است. چالشهای اصلی که برای توسعه این باتریها وجود دارند عبارتند از: 1) نبود درک کافی از نحوه تأثیر الکترولیت/الکترود روی سینتیک واکنش و ظرفیت دشارژ قابل دستیابی (یعنی مقدار KO2 قابل ذخیرهسازی)، 2) استفاده از اکسیژن خالص بجای هوا باعث افزایش پیچیدگی و هزینه سیستم میشود 3) مسائل ایمنی مربوط به واکنشپذیری بالای فلز پتاسیم.
در این مقاله، پیشرفتهای اخیر در زمینه باتریهای K-O2 را مرور میکنیم و نگاهی میاندازیم به اینکه چگونه این اطلاعات نظری و تجربی به توسعه باتریهای K-O2 کمک میکنند. ما در ابتدا عوامل تأثیرگذار بر بازگشتپذیری و پایداری الکترود اکسیژن را بررسی میکنیم که شامل طراحی الکترولیت، مکانیزم رشد، محیط عملیاتی، مکانیزم تجزیه شیمایی و طراحی فصل مشترک الکترولیت-الکترود است. سپس روشهای موجود برای پایدارسازی آند پتاسیم و ساخت آندهای جایگزین برای کاهش مشکلات مربوط به پایداری و ایمنی فلز پتاسیم را بررسی میکنیم. علاوه بر این، امکان ساخت سیستمهای بسته بر اساس تبدیل KO2-K2O2 ارزیابی میشود. در آخر نیز مسیر تحقیقات بعدی برای تجاریسازی باتریهای K-O2 را بررسی میکنیم.
2- طراحی باتریهای کارآمد K-O2
1-2 بازگشتپذیری و پایداری الکترود اکسیژن
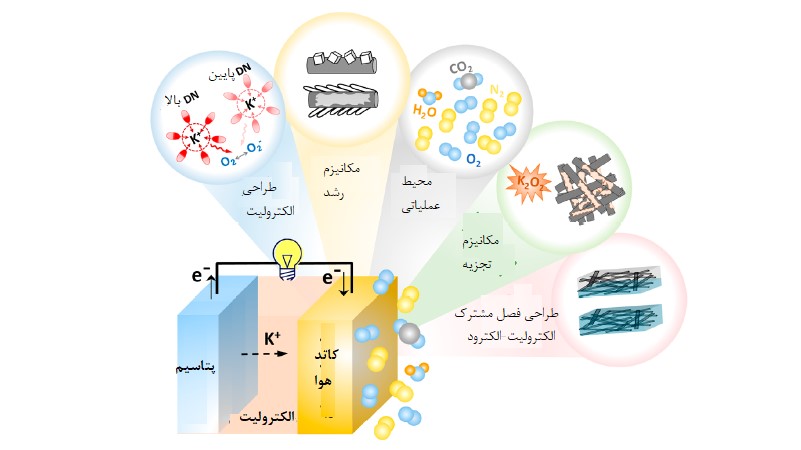
تشکیل و تجزیه برگشتپذیر محصولات حاصل از فرایند تخلیه در الکترود اکسیژن بعنوان شرط لازم برای ساخت باتریهای K-O2 کارآمد با طول عمر زیاد شناخته میشود. درک خواص فیزیکی شیمیایی که مورفولوژی، بازگشتپذیری، ظرفیت و پایداری محصولات حاصل از واکنش را کنترل میکنند یک مرحله کلیدی برای دستیابی به یک باتری کاربردی است. در این مقاله سعی داریم تا 5 موضوع مهم در مورد الکترود اکسیژن یعنی طراحی الکترولیت، مکانیزم رشد، شرایط عملیاتی، مکانیزم تجزیه و طراحی فصل مشترک الکترود-الکترولیت را بررسی کنیم.
طراحی الکترولیت: تأثیر الکترولیت روی سینتیک، بازگشتپذیری و ظرفیت باتری. بررسی تأثیر حلال روی باتریهای K-O2 نسبت به تحقیقات انجام شده روی باتریهای Li-O2 و Na-O2 بسیار محدود است [3,14-16]. از زمان نخستین مقاله منتشر شده توسط رن و وو [8] در سال 2013 در مورد تشکیل و تجزیه برگشتپذیر KO2 بصورت الکتروشیمیایی در باتریهای K-O2، الکترولیتهای با پایه اتر و عدد اهدای الکترون[1] (DN) پایین مانند 1، 2- دیمتوکسی اتان (DME) و دیگلایم[2] (DG) بعنوان سیستم پیشفرض برای الکترولیت استفاده شدهاند [17,18].
حلالهای با عدد DN بالا مانند دیمتیل سولفوکسید (DMSO) در این سیستمها بررسی نشدهاند چون با آند فلز پتاسیم یک واکنش گرمازا انجام میدهند [19]. با در نظر داشتن اینکه اولین مرحله در واکنش احیای اکسیژن (ORR) در باتریهای K-O2 شامل تشکیل ترکیب واسطه O2– است بنابراین اعتقاد داریم که عدد DN حلال الکترولیت نقش حیاتی در سینتیک و بازگشتپذیر بودن واکنش انجام شده بین ترکیبات واسطه و محصولات دارد.
بر اساس اصل اسید و باز نرم و سخت (HASB) [20,21]، حلالهای با قدرت اهداکنندگی زیاد (عدد DN بالا) میتوانند از بار مثبت کاتیون محافظت کنند و آن را به یک اسید نرم تبدیل کنند که یک باز نرم (مانند O2–) را پایدار میکند.
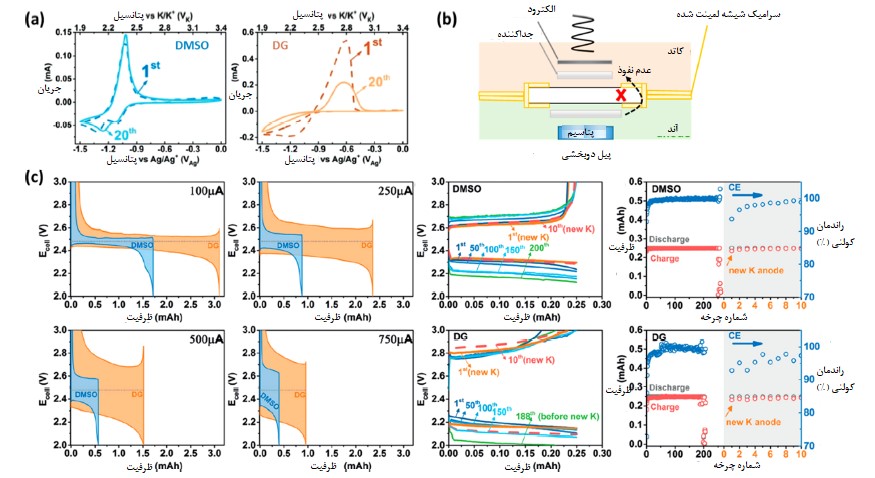
با در نظر داشتن این نکته، ما از حلال DMSO که یک حلال شدیدا الکترونده است برای پایدارسازی محصول فرایند تخلیه باتریهای K-O2 (یعنی KO2) استفاده کردیم تا بازگشتپذیری و سینتیک انتقال بار O2/KO2 روی حلالهای با پایه دیمتوکسی سیلان را بهبود بخشیم. دو پیک شاخص در DMSO حاوی K+ دیده شد (شکل a3) که میتوان آنها را به تشکیل KO2 و K2O2 نسبت داد [22].
ما نشان دادیم که واکنشهای اکسایش/کاهش O2/KO2 در حلال DMSO سینتیک سریع و بازگشتپذیری بالایی دارند که با واکنش اکسایش/کاهش آهسته در حلال DG با ماهیت غیرفعالسازی[3] در تضاد است (شکل a3) [23]. ثابت سرعت استاندارد (ks) بدست آمده بصورت تجربی در حلال DMSO حدود 4 برابر بزرگتر از این ثابت در حلال DG است.
این نتایج با مشاهدات لائوره و همکارانش [20] همخوانی دارند چون آن ها نیز ثابت سرعت استاندارد بالاتری را برای واکنش ORR در حلال DMSO نسبت به الکترولیت با پایه DG در حضور TBA+ یا Li+ گزارش کردند. ما فکر میکنیم که برهمکنش شدید بین K+ و DMSO (کمپلکس K+-(DMSO)n) میتواند اسیدیته لوییس (چگالی بار) K+ را کاهش دهد که طبق اصل HASB باعث افزایش تمایل نسبت به باز نرم O2– میشود، در نتیجه بازگشتپذیری و سینتیک واکنش اکستیش/کاهش در الکترولیت DMSO بهبود مییابد.
با طراحی یک پیل K-O2 دوبخشی که توسط یک الکترولیت حالت جامد K+ (الکترولیت جامد K-βn-Al2O3) از هم جدا شدهاند نشان دادیم که استفاده از حلال DMSO بجای DG بعنوان الکترولیت کاتد در باتری K-O2 باعث اضافه ولتاژ کمتر (اورولتاژ)، سرعت شارژ بالاتر و چرخه عمر طولانیتر این باتریها میشود (شکلهای b,c3). یک پژوهش جامع در مورد سینتیک واکنش ORR در حلال DMSO با استفاده از یک الکترود صفحه-حلقهای چرخان (RRDE) توسط سانکاراسوبرامانیان و همکارانش [24] انجام شد که مزایای استفاده از حلال DMSO به عنوان یک الکترولیت کارآمد در باتریهای K-O2 را تأیید کرد. علاوه بر این، تأثیر آنیونها روی سینتیک واکنش ORR و ضرایب نفوذ O2 در حلال DMSO توسط سانکاراسوبرامانیان و همکارانش [25] بررسی شد که در آن از آنیونهای پرکلرات (ClO4–)، تریفلورومتان سولفنات (OTf–)، هگزافلوروفسفات (PF6–) و بیس (تریفلورومتان سولفنیل)-ایمید (TFSI–) استفاده کردند.
این نویسندگان پروفایلهای پولاریزاسیون الکترودهای متقارن اکسیژن را با استفاده از الکترولیتهای K+ با پایه DMSO بررسی کردند. آنیونهای PF6– و ClO4– اضافه ولتاژ کمتری را نسبت به آنیونهای OTf– و TFSI– نشان دادند که ناشی از حلالپوشی بوجود آمده توسط این آنیونها است. نتایج نشان داد که تشکیل جفتهای یونی جداکننده حلال [K+-(DMSO)n-ClO4– + (DMSO)m-ClO4–] و عدم حلالپوشی آنیون (PF6– خالی) باعث کاهش اضافه پتانسیل واکنش ORR میشود. در عوض، آنیون OTf– با داشتن عدد DN بالا باعث حلالپوشی جزئی (غالبا K+-(DMSO)n-OTf–)، پایداری ضعیف O2/O2– و اضافه پتانسیل بیشتر میشود.
همچنین آن ها نشان دادند که ضرایب نفوذ اکسیژن در الکترولیت PF6– نسبت به الکترولیت ClO4– بزرگتراند. الکترولیت TFSI– بعنوان یک الکترولیت مناسب انتخاب شد چون پلاریزاسیون ولتاژ بالایی دارد. KPF6 در DMSO بدلیل متعادل کردن انتقال اکسیژن و پیشنیازهای سینتیکی بعنوان یک الکترولیت مناسب در باتریهای K-O2 پیشنهاد شد [25] که با فرمول الکترولیت استفاده شده در مقاله ما همخوانی دارد [23].
شکل 2 عوامل اصلی که بازگشتپذیری و پایداری الکترود اکسیژن را کنترل میکنند
شکل 3 (a) ولتاموگرامهای چرخهای در DMSO و DG، (b) شماتیکی از یک پیل سوختی دوبخشی و پوشیده شده با پلیمر، (c) پروفایلهای ولتاژ گالوانواستاتیک باتریهای K-O2 با پایه DMSO و DG. شکلهای (a) و (c) با کسب اجازه از مقاله 23 منتشر شدهاند
علیرغم این یافتهها که DMSO را بعنوان یک الکترولیت مناسب برای سینتیکهای سریع و بازگشتپذیری بالا معرفی کردند، ظرفیت تخلیه DMSO به مراتب کمتر از DG است چون غیرفعالسازی سریع الکترود منجر به رشد کریستالهای KO2 میشود (بخش بعد). علاوه بر این، واکنش شدید بین DMSO و فلز پتاسیم باید بررسی شود. بنابراین به تحقیقات بیشتری نیاز داریم تا بتوانیم الکترولیتهای جدیدی طراحی کنیم که سینتیک سریع، بازگشتپذیری بالا و ظرفیت تخلیه شارژ زیادی را فراهم کنند. برای استفاده از این باتریها در شرایط واقعی نیز باید تحقیقات بیشتری در زمینه محافظت از آند یا ساخت آندهای جایگزین برای تعویض فلز پتاسیم انجام دهیم.
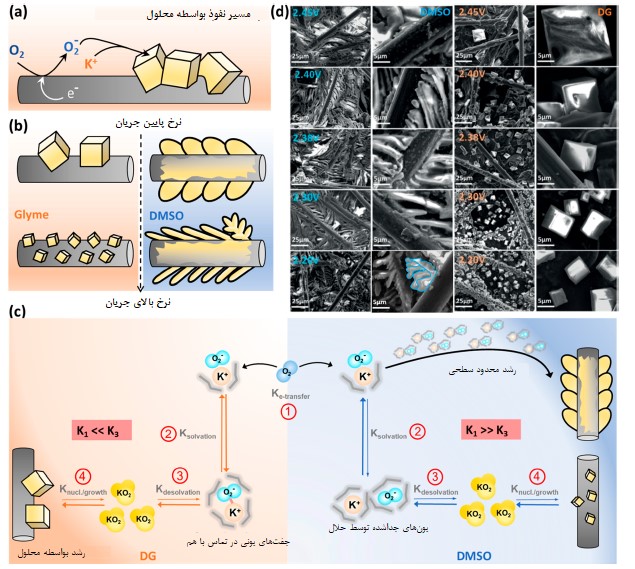
شکل 4 تأثیر الکترولیت و سرعت جریان تخلیه شارژ روی مورفولوژی و مکانیزم رشد محصول حاصل از فرایند تخلیه شارژ. (a) شماتیکی از رشد KO2 بهواسطه محلول در باتریهای K-O2. (b) شماتیکی از مورفولوژیهای محصول فرایند تخلیه شارژ در جریانهای مختلف در باتریهای K-O2. (c) شماتیکی از مکانیزم رشد KO2 در حلالهای DMSO و DG با الهام از باتریهای Na-O2 [26]. (d) تصاویر SEM از رشد KO2 در DMSO و DG در ولتاژهای مختلف. تصاویر بخش (d) با اجازه از مقاله [23] منتشر شدهاند
مکانیزم رشد KO2.ظرفیت تخلیه شارژ قابل دستیابی در باتری پتاسیم هوا با مورفولوژی محصول حاصل از فرایند تخلیه شارژ رابطه نزدیکی دارد که مکانیزم رشد این محصول (KO2) آن را کنترل میکند. انتخاب حلال الکترولیت یکی از مهمترین فاکتورها در تعیین مکانیزم رشد KO2 در باتری پتاسیم هوا است که میتواند روی سینتیک واکنش، انحلالپذیری O2، انحلالپذیری KO2، ویسکوزیته، قابلیت جابجایی O2/KO2 و غیره اثر بگذارد.
در تحقیقات انجام شده در زمینه الکترولیتهای با پایه گلایم[4] مشخص شده است که رشد KO2 از یک مسیر با استفاده از حلال پیروی میکند که در آن، ابتدا رادیکال سوپراکسید روی سطح الکترود تشکیل میشود و سپس به درون الکترولیت نفوذ میکند و نهایتا با K+ ترکیب میشود و روی کریستال KO2 موجود تهنشین می شود که نهایتا کریستالهای مکعبی شکل KO2 شکل میگیرند (شکل a4) [17].
با این حال فهمیدیم که کریستالهای KO2 که در حلال DMSO با عدد DN بالا شکل میگیرند دارای یک سطح نازک و سوزنی شکل هستند که شکل خود را از الکترود کربن میگیرند (شکل b4) که این مورفولوژی در تضاد شدید با شکل کریستالهای مکعبی شکل تشکیل شده روی سطح حلال DG با عدد DN پایین است (شکل b4) [23].
حلال الکترولیت نقش مهمی در مورفولوژی و مکانیزم رشد این کریستالها دارد (شکل b4) در حالیکه جریان تخلیه اعمال شده عمدتا روی اندازه/توزیع کریستالها یا نوک تیز بودن کریستالهای KO2 سوزنی شکل تأثیر میگذارد. برای توجیه تفاوت مشاهده شده در مورفولوژی این کریستالها در حلالهای DMSO و گلایم از فرضیه موجود در باتریهای Na-O2 [26] برای باتری پتاسیم هوا استفاده میکنیم که به انرژی حلالزدایی[5] ربط دارد.
در اصل، KO2 میتواند حلال را بطور آهسته اشباع کند و به صورت مکعبهای بزرگ بر روی سطح الکترود تشکیل شود. زمانی که حلال با KO2 اشباع شد، برای حفظ کریستالسازی و رشد مناسب کریستالها باید حلالزایی KO2 از محلول (kdesolvation) سریعتر از تشکیل KO2 باشد (ke-transfer).
اگر مانع انرژی برای حلالزایی افزایش یابد آنگاه از تجزیه بیشتر این محصول جلوگیری میشود و منجر به جابجا شدن شبه تعادل موجود بین تشکیل محصول و حلالپوشی به سمت رشد محدود KO2 روی سطح میشود [26].
همانطور که در شکل c4 مشخص است، حلال DMSO بدلیل داشتن عدد DN و عدد پذیرش الکترون[6] (AN) بالاتر نسبت به الکترولیتهای با پایه گلایم باعث تشکیل یونهای جداشده از حلال است [25] که منجر به افزایش ممانعت برای حلالزایی میشوند و به همین دلیل ke-transfer >> kdesolvation میباشد و شاهد رشد محدود KO2 روی سطح الکترولیت هستیم (شکل فیلم مانند).
با افزایش چگالی بار، اندازه کریستالهای مکعبی KO2 در حلال DG کم میشود (شکل d4) و کریستالهای KO2 سوزنی شکل در حلال DMSO نیز نوکتیزتر میشوند به نحوی که برخی از کریستالها به شکل دندریت (بلور شاخهای) در میآیند (شکل d4).
تشکیل این کریستالهای شاخهای در چگالی جریان بالا میتواند ناشی از گرادیان غلظت O2 باشد که به دلیل سریعتر بودن نرخ مصرف اکسیژن نسبت به نرخ تولید آن توسط نفوذ از محلول بوجود میآید.
یک ساختار فراکتال[7] ممکن است در ناحیه با غلظت کمتر تشکیل شود که در آن، برآمدگیها (بیرونزدگی[8]) مستعد شکلگیری هستند چون انتقال جرم به این برآمدگیها بعنوان کارآمدترین مسیر برای انتقال جرم شناخته میشود (با فرض اینکه KO2 تشکیل شده دارای رسانایی الکتریکی کافی [27] برای انجام واکنش ORR باشد).
برای بررسی بهتر رشد KO2 در باتری پتاسیم هوا باید در تحقیقات بعدی، مورفولوژی رشد کریستالهای KO2 در الکترولیتهای آلی را مطالعه کنیم. علاوه بر حلالها، عوامل دیگری نظیر نمکها، افزودنیها (مانند آب)، ترکیبات واسطه اکسایش-کاهش و کریستالها ممکن است روی مورفولوژی محصولات حاصل از تخلیه شارژ تأثیر بگذارند [28].
تحقیق بیشتر روی بررسی تأثیر این عوامل روی انحلالپذیری KO2، ضریب نفوذ اکسیژن و سینتیک واکنش میتواند درک ما از مورفولوژی و مکانیزم رشد KO2 در باتریهای K-O2 را افزایش دهد.
محیط عملیاتی: اکسیژن در مقابل هوای محیط.
استفاده از اکسیژن خالص در آزمایشگاه بجای هوای محیط به عنوان یکی از پیشنیازهای دستیابی به باتریهای قابل شارژ فلز-هوا شناخته میشود. هوای ناخالص محیط شامل ناخالصیهایی نظیر CO2 و H2O است (H2O تا حدود 3 درصد و حدود 04/0 درصد CO2).
برای درک نحوه استفاده عملی از باتری فلز-هوا در شرایط هوای محیط باید تأثیر ناخالصیهای موجود در هوا (H2O، CO2، N2 و غیره) روی بازگشتپذیری و عملکرد باتریهای فلز-اکسیژن را بررسی کنیم. بر همین اساس، تلاشهای زیادی در زمینه باتریهای لیتیوم-هوا انجام شده است [29-35] اما تحقیقات کمی روی باتریهای Na-هوا [36,37] و K-هوا [38] صورت گرفته است و تحقیقات بسیار اندکی در شرایط استفاده از هوای خالص انجام شدهاند.
اخیرا کین و همکارانش واکنشپذیری KO2 را توسط پودر تجاری KO2 و در محیطهای گازی مختلف (کربن دیاکسید خشک، کربن دیاکسید مرطوب، هوای خشک و غیره) بررسی کردند و به این نتیجه رسیدند که KO2 در هوای خشک دارای پایداری بالایی است ولی در حضور رطوبت پایدار نیست [38].
قبل از استفاده کردن از هوا در باتریهای فلز-هوا باید رطوبت موجود در آن را جدا کنیم. بر همین اساس، یک باتری قابل شارژ پتاسیم-هوای خشک با پایه گلایم و KO2 بعنوان محصول فرایند تخلیه شارژ با موفقیت ساخته شد.
ما تأثیر CO2 و H2O موجود در هوای محیط روی باتری پتاسیم هوا با پایه DMSO را بررسی کردیم [13]. با ارزیابی کاتد اکسیژن بطور مستقل و بدون دخالت آند نشان دادیم که کاتد اکسیژن با پایه K میتواند بصورت پایدار در هوای محیط (دارای H2O) کار کند به نحوی که KO2 محصول اصلی فرایند دشارژ آن است [13].
همچنین ما نشان دادیم که واکنشپذیری سوپراکسید فلزی نقش مهمی در تعیین بازگشتپذیری کاتد در هوای محیط دارد که این نتایج توسط آنالیز ترمودینامیکی و طیفسنجی جرم بصورت الکتروشیمیایی و درون خطی[9] (OEMS) تأیید شد.
الکترود اکسیژن با پایه K+ نسبت به الکترودهای با پایه Li+ و Na+ دارای عملکرد بهتری در حضور ناخالصیهای CO2/H2O است. علاوه بر این، تأثیر آب و کربن دیاکسید ارزیابی شد. تحقیقات انجام شده روی کاتد اکسیژن با پایه K+ نشان داد که آب باعث آسیب ناچیزی به واکنش اکسایش-کاهش O2/KO2 میشود به نحوی که غلظت ppm1000 از آن در الکترولیت نیز مشکلی ایجاد نمیکند.
در عوض، غلظتهای بیشتر از 20 درصد کربن دیاکسید تأثیر مخربی بر کاتد اکسیژن داشت. نهایتا توانستیم باتریهای با پایه KO2 با پایداری چرخهای بالا (1000 چرخه در mAh/cm2 25/0 و 400 چرخه در mAh/cm2 1) بدست آوریم. انتخاب حلال میتواند نقش بسزایی در پایداری بالاتر باتری پتاسیم هوا با پایه DMSO در برابر آب داشته باشد.
همچنین گزارش شد که مولکولهای DMSO میتوانند یک ساختار پلیمری محکم را از طریق پیوند هیدروژنی با آب بسازند و قابلیت هجوم آب به سوپراکسید را کاهش دهند [39]. علاوه بر این، استفاده از الکترولیت جامد باعث حذف تمامی اثرات جانبی آب روی آند خواهد شد.
این یافتهها به ما کمک میکنند تا شروط لازم برای دستیابی به کاتد پایدار K+-هوا در هوای محیط را بدست آوریم و از آنها در ساخت باتری پتاسیم هوا استفاده کنیم. باتری هوا با پایه پتاسیم نشان داده شده در اینجا به عنوان نمونه اولیه ایده فوق محسوب میشود و هنوز راه درازی تا کاربرد عملی آنها در پیش داریم.
بنابراین برای ساخت باتریهای پتاسیم هوا با استفاده از هوای محیط به تحقیقات اساسی برای برطرف کردن مشکلات آنها نظیر وجود آلایندههای گازی در هوا، تبخیر الکترولیت آلی، ناپایداری آند و حفاظت از آند نیاز داریم.
مکانیزم تجزیه شیمیایی الکترود اکسیژن.
اگرچه باتری پتاسیم هوا نسبت به باتریهای Li-O2 و Na-O2 راندمان رفت و برگشتی بهتر و چرخه حیات طولانیتری دارد اما همچنان با مشکل افزایش شدید اضافه پتانسیل و افت ظرفیت مواجه است. با استفاده از روشهای دگرجا[10] شاهد تولید محصولات جانبی با پایه کربنات در الکترود کاتد بودیم [23,40].
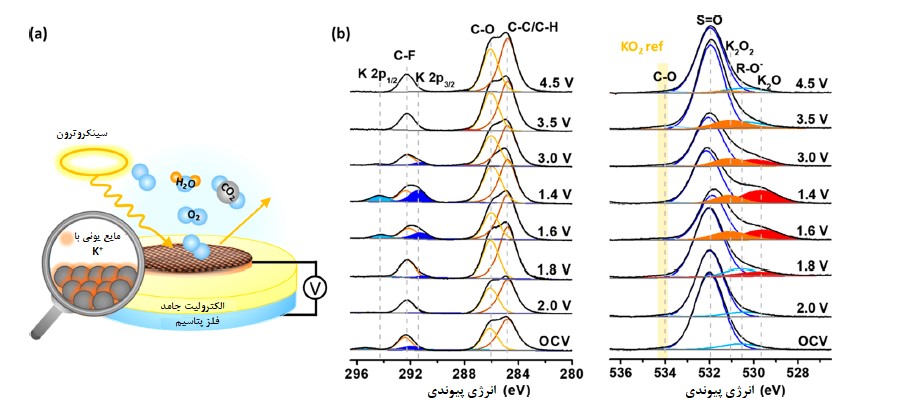
به منظور درک بهتر مکانیزم تجزیه شیمیایی و فرایندهای الکتروشیمیایی در فصل مشترک جامد/مایع/گاز باتریهای پتاسیم هوا سعی کردیم که واکنش احیا/آزادسازی اکسیژن در یک باتری پتاسیم هوا را توسط آنالیز طیفسنجی فوتوالکترونی اشعه ایکس در فشار محیط (APXPX) در باتریهای هوا با پایه مایع یونی بررسی کنیم (شکل a5) [41,42]. نتایج ما نشان داد که فرایند دو و چهار الکترونی در واکنشهای K-O2 نقش دارند.
با این حال نشان دادیم که تشکیل و اکسیداسیون متعاقب K2O2 باعث کاهش راندمان کولنی (CE) و راندمان انرژی (EE) باتریهای پتاسیم هوا میشود که با پژوهشی که اخیرا انجام شده [42] همخوانی دارد. پایین بودن راندمان CE و EE ممکن است به دلیل تشکیل آنیون شدیدا هستهدوست سوپراکسید (O2–) یا O2 تشکیل شده در ولتاژ بالای جریان (بزرگتر مساوی 45/3 ولت) باشد [44].
تأثیر ناخالصیهای رایج مانند H2O و CO2 نیز از طریق تست APXPS بررسی شد. زمانی که فرایند تخلیه در حضور H2O و CO2 انجام شود شاهد تشکیل گونههای با پایه کربنات هستیم.
یافتههای ما نشان میدهد که جلوگیری از تشکیل K2O2 در باتریهای پتاسیم هوا برای حفظ بازگشتپذیری بالای این باتریهای ضروری است. برای بررسی امکان انجام واکنش برگشتپذیر KO2/K2O2 در یک سیستم بسته باید تحقیقات بیشتری در زمینه شناسایی یک محفظه اکسایش-کاهش یا یک بستر کاتدی مناسب انجام شود.
شکل 5 (a) شماتیک باتری پتاسیم هوا طراحی شده برای آنالیز APXPX، (b) دادههای آنالیز APXPS از C 1s، K 2p و O 1s بدست آمده از سطح بالای پیل سوختی K-O2 حین فرایندهای شارژ و تخلیه شارژ. نتایج شکل (b) با اجازه از مقاله [41] منتشر شدهاند
طراحی فصل مشترک الکترولیت-الکترود برای استفاده بهتر از الکترود.
الکترود جامد، اتمسفر O2 و الکترولیت مایع یک کاتد K-O2 باعث ایجاد یک فصل مشترک سه فازی میشوند که واکنشهای ORR و آزادسازی اکسیژن (OER) در آنجا رخ میدهند. بهینهسازی طراحی فصل مشترک الکترود-الکترولیت کاتد برای ماکزیمم کردن استفاده از سطح تماس هوا-الکترود و بهبود عملکرد آن ضروری است.
گوردین و همکارانش [45] از روشهای پلاریزاسیون و آنالیز امپدانس (مقاومت ظاهری) برای بررسی تأثیر مقدار الکترولیت روی پیک جریان و توان خروجی استفاده کردند تا بتوانند این فصل مشترک سه فازی را تنظیم کنند. آن ها منحنیهای پلاریزاسیون (توان خروجی) و مقاومت ظاهری را در سه حالت بررسی کردند تا بتوانند مقدار الکترولیت را بهینهسازی کنند.
این سه حالت عبارتند از: (1) الکترولیت تمام حجم خالی کاتد را پر کند که این کار باعث حداکثر تماس سطح فعال کاتد با اکسیژن حل شده در الکترولیت میشود؛ (2) الکترولیت بطور کامل این حجم خالی را پر نکند به نحوی که فقط بخشی از سطح تماس اکسیژن/الکترولیت برای واکنشهای انتقال بار در دسترس باشد؛ (3) کاتد با مقادیر زیادی از الکترولیت پرشده است به نحوی که کل سطح کاتد در دسترس باشد ولی واکنش انتقال بار توسط کاهش جریان اکسیژن بدلیل طولانیتر شدن مسیر نفوذ O2 محدود خواهد شد.
نتایج نشان داد که حالت اول، بیشترین توان خروجی را به ما میدهد. علاوه بر این، مجموعهای از پیلهای سوختی K-O2 با حجمهای مختلف از الکترولیت نسبت به حجم کل فضای خالی موجود در جداکننده و کاتد کربن متخلخل (E/V) در فشار اکسیژن 9.860.01 kPa ارزیابی شدند. زمانی که E/V بین 83 تا 99 درصد بود شاهد ماکزیمم شدن جریان حدی[11] و توان خروجی از این باتریها بودیم.
کاتد پرشده به صورت نسبی (E/V 73%) و پرشده با مقادیر اضافی از الکترولیت (E/V114-146%) باعث کاهش جریان و توان خروجی از باتریهای K-O2 شدند. حجمی از الکترولیت که به خوبی با حجم فضای خالی کاتد تطابق دارد باعث بهینهسازی سطح تماس در دسترس برای انجام واکنش الکتروشیمیایی میشود و یک مسیر مناسب را برای نفوذ اکسیژن حل شده فراهم میکند، در نتیجه جریان حدی و توان خروجی را ماکزیمم خواهد کرد.
این پژوهش روش مناسبی برای درک نحوه طراحی سیستم هوا-الکترود و استفاده از استراتژیهای منطقی برای طراحی الکترود ارائه میدهد.
آن ها نشان دادند که متناسب کردن حجم الکترولیت با حجم فضای خالی کاتد نقش مهمی در عملکرد این باتریها (بار حدی و توان خروجی) دارد. الکترولیت کافی باید در سطح مشترک سه فاز وجود داشته باشد تا حداکثر دسترسی الکتروشیمیایی و حداقل مسیر نفوذ اکسیژن فراهم شود.
تحقیقات بیشتر در زمینه نسبت وزن الکترولیت-الکترود به حجم فضای خالی آن و تأثیر این پارامتر بر سینتیک الکترود، ظرفیت تخلیه شارژ، مورفولوژی KO2 و بازگشتپذیری پیل سوختی به ما کمک خواهد کرد تا الکترودهای K-O2 با کارآیی بالا، ظرفیت انرژی خوب و توان خروجی بالا طراحی کنیم. علاوه بر این، تأثیر فشار نسبی اکسیژن روی الکترولیت-الکترود باید بررسی شود.
2-2 پایدارسازی آند و استفاده از آند جایگزین
طراحی آند نقش مهمی در تعیین عملکرد باتریهای پتاسیم هوا دارد. معلوم شده است که آندهای شدیدا واکنشپذیر از جنس فلز پتاسیم با چالشهایی در زمینه عمر باتری و مشکلات ایمنی مواجه هستند [46]. مشکلات اساسی در زمینه استفاده از پتاسیم در آند باتری گزارش شده است که عبارتند از: عبور اکسیژن، تجزیه الکترولیت، رشد ساختار شاخهای پتاسیم و غیره [40,47].
این چالشها باعث شدهاند تا تلاشهای زیادی در زمینه پایدارسازی و اصلاح آند انجام شود به نحوی که شاهد مقالات مروری عالی درباره چالشها و پایدارسازی سطح مشترک الکترولیت جامد (SEI) به همراه طراحی الکترولیت-آند در باتریهای پتاسیم هوا و پتاسیم-یونی بودهایم [48,49]. در اینجا سعی داریم تا روی ساخت آندهای جایگزین و کاربردهای احتمالی آن ها در باتریهای پتاسیم هوا تمرکز کنیم.
مک کولاچ و همکارانش [50] برای اولین بار آند جایگزین K3Sb را در باتریهای پتاسیم هوا استفاده کردند که متوسط تخلیه شارژ 8/1 ولت را در mA/gantimony 20 (یا mA/cm2 04/0) داشت اما تشکیل K3Sb با انبساط حجم حدودا 400 درصدی همراه است که باعث افت ظرفیت باتری میشود.
یو و همکارانش [18] یک آند مایع بر اساس آلیاژ Na-K را گزارش کردند که برای ساخت اولین باتری پتاسیم هوا عاری از ساختار شاخهای استفاده شد و یک فلات پتانسیل تخلیه شارژ در 45/2 ولت (mA/cm2 05/0) داشت. ما یک آند مایع بیفنیل-K (یا BpK) را گزارش کردیم تا با الکترود هوای دارای سینتیک سریع و حلال DMSO جفت شود.
این آند BpK دارای پتانسیل اکسایش-کاهش پایین (0.35 vs K/K+)، بازگشتپذیری بالا، سینتیک سریع و ایمنی بالا نسبت به فلز K بود [51]. باتری BpK-O2 ساخته شده دارای 3000 چرخه رفت و برگشتی پایدار بود که نتایج آنالیزهای انجام شده روی آن مانند OESM، طیفسنجی مادون قرمز تبدیل فوریه (FTIR) و پراش اشعه ایکس (XRD) نیز آن را تأیید کرد [51].
همچنین این آند مایع را میتوان به آسانی توسط حل کردن پتاسیم در محلولی از هیدروکربنهای آروماتیک و اترها تهیه کرد [52]. علاوه بر این ما نشان دادیم که افزودن گروه الکترونده متیل به حلقه بنزن این مواد میتواند پتانسیل اکسایش-کاهش Bp را کاهش دهد که نشان دهنده پتانسیل آندهای آلی و مایع برای استفاده در باتریهای اکسیژنی است.
نتایج نشان داد که افزودن گروه عاملی متیل میتواند یک استراتژی مناسب برای کاهش پتانسیل اکسایش-کاهش آند BpK باشد که این کار را با افزایش انرژی LUMO (کاهش الکترونخواهی مولکول) انجام میدهد.
اخیرا آند گرافیت پتاسیمدار شده (KC8) توسط وو و همکارانش در یک باتری یون پتاسیم-اکسیژن استفاده شده است [53]. قبل از اینکه آند یاد شده با الکترود اکسیژن و الکترولیت دارای غلظت بالای پتاسیم بیس (تریفلورو متان سولفنیل) ایمید (KTFSI) ترکیب شود باید در محلول KFSI/DME شسته شود (KFSI مخفف پتاسیم بیس (فلوروسولفنیل) ایمید است) تا یک SEI مصنوعی در پیل سوختی K/گرافیت تشکیل شود و فرایند پتاسیمدار شدن تکمیل شود.
باتری KC8-اکسیژن بدست آمده دارای 80 چرخه رفت و برگشتی پایدار بود. این پژوهش مسیر را برای ساخت آندهای گرافیتی جهت استفاده در باتریهای سوپراکسید با پایه KO2 هموار کرد. اگرچه استفاده از K3Sb، آلیاژ Na-K و KC8 بعنوان آند باعث بهبود عملکرد باتری میشود ولی چرخه حیات آنها بدلیل عبور اکسیژن نسبتا پایین است. برای برطرف کردن این مشکل باید بدنبال ساخت یک الکترولیت جامد یا یک الکترولیت هیبریدی [54] برای حذف کامل معضل عبور اکسیژن باشیم.
برای درک بهتر پتانسیل استفاده از آندهای جایگزین در باتریهای K-O2، خواص الکتروشیمیایی آنها و عملکرد این باتریها در جدول 1 با هم مقایسه شده است. K3Sb و آلیاژ Na-K مزایای قابل توجهی نسبت به سایر گزینهها از نظر ظرفیت انرژی ثقلی دارند در حالیکه KC8 و آلیاژ Na-K از لحاظ ولتاژ دارای عملکرد بهتری هستند.
اگرچه BpK پایینترین ظرفیت را نسبت به سایر آندها دارد ولی از نظر پایداری چرخههای رفت و برگشتی و سرعت شارژ دارای عملکرد بهتری است. افزودن فلز پتاسیم به محلول اشباع BpK-DME میتواند ظرفیت انرژی ثقلی پایین این آند را بهبود بخشد که این یافتهها در مقاله یو و همکارانش [55] نیز دیده میشود. افزودن فلز Na به محلول اشباع از BpNa-DME نیز باعث دستیابی به چگالی انرژی بالاتر خواهد شد. در این حالت، الکترولیت مایع به عنوان یک عامل ترکننده[12] عمل میکند و نقش واسطه بین فلز Na و الکترولیت جامد دارد. این کار باعث میشود تا تماس فیزیکی خوبی بین مواد برقرار شود، توزیع یکنواختی از چگالی بار را داشته باشیم و از تشکیل ساختارهای شاخهای جلوگیری شود.
جدول 1 خلاصهای از مواد اخیرا استفاده شده بعنوان آند برای باتریهای اکسیژنی با پایه پتاسیمa
| آند | ظرفیت نظری (mAh/g) | ولتاژ خروجی (V) | راندمان کولنی اولیه (%) | بهترین عملکرد | مرجع |
| K3Sb | 660 | حدود 8/1 | حدود 92 | 8 چرخه در mA/cm2 04/0 | 50 |
| آلیاژ Na-K | 579 | حدود 45/2 | حدود 40 | 70 چرخه در mA/cm2 05/0 | 18 |
| BpK در DME | 2/85 | حدود 1/2 | حدود 90 | 3000 چرخه در mA/cm2 4 | 51 |
| KC8 | 279 | حدود 25/2 | 7/81 | 80 چرخه در mA/cm2 044/0 | 53 |
| فلز K | 685 | 48/2 |
a (1) ظرفیت نظری آلیاژ Na-K از مقاله [56] بدست آمده است. (2) بالاترین غلظت BpK در DME برابر با 3 مولار است. در این غلظت، ماکزیمم ظرفیت آند بدست میآید
3- نتیجهگیریها و چشمانداز آینده باتری پتاسیم هوا
پیشرفتهای زیادی در زمینه درک مبانی شیمی و الکتروشیمی باتریهای بیپروتون پتاسیم هوا صورت گرفته است. باتریهای پتاسیم هوا راندمان انرژی بالاتر و چرخه حیات طولانیتری دارند که آن ها را به یک گزینه آیندهدار برای کاربردهای عملی تبدیل میکند.
تحقیقات انجام شده در زمینه واکنشهای احیا/آزادسازی اکسیژن در الکترود هوا نشان داده است که محلولهای الکترولیت دارای عدد DN بالا (مانند DMSO) میتوانند سینتیک واکنش اکسایش-کاهش O2/KO2، بازگشتپذیری و پایداری را نسبت به حلالهای با عدد DN پایین (مانند گلایم) بهبود بخشند.
علاوه بر این، خود الکترولیت نقش تعیین کنندهای در مورفولوژی رشد K-O2 دارد که روی ظرفیت نهایی بدست آمده از باتری نیز اثر میگذارد. برای استفاده از هوای محیط به جای اکسیژن خالص نیز نشان دادیم که سیستم پتاسیم هوا به عنوان پایدارترین سیستم در مقایسه با سیستمهای Li-O2 و Na-O2 شناخته میشود که دلیل آن پایداری شیمیایی بالای KO2 است.
نتایج آنالیز APXPS انجام شده برای بررسی تأثیر واکنش ORR/OER در باتری K-O2 نشان داد که تشکیل K2O2 باعث برگشتناپذیر شدن چرخههای باتری میشود که این مشکل را میتوان در باتریهای K-KO2/K2O2 با سیستم بسته برطرف کرد.
برای استفاده بهتر و راحت از باتریهای پتاسیم هوا باید تحقیقات بیشتری انجام شود. ما بر این باوریم که موارد زیر برای کمک به حل مشکلات باتریهای فوق مفید هستند:
- طراحی الکترولیت کاتد. در حالیکه حلال DMSO توانست سینتیک سریع و چرخههای پایداری را نشان دهد ولی مشکل اصلیاش مربوط به ظرفیت نهایی پایین آن به دلیل غیرفعال شدن الکترود توسط کریستالهای سوزنی یا شاخهای شکل KO2 است. ساخت یک الکترولیت جدید با سینتیک سریع برای واکنش ORR و تحرک/پایداری بالای اکسیژن (ویسکوزیته پایین) برای برطرف کردن مشکل پایین بودن ظرفیت DMSO مفید است.
- طراحی فصل مشترک سه فازی کاتد. به منظور استفاده حداکثری از الکترود و بهبود سرعت واکنشها در آن پیشنهاد شده است که سطح تماس الکترود-الکترولیت کاتد بهینهسازی شود. به تحقیقات زیادی در مورد ساختار الکترولیت-الکترود کاتد اکسیژن و تأثیر آن بر سینتیک الکترود و بازگشتپذیری پیل سوختی نیاز داریم تا بتوانیم الکترودهای K-O2 با راندمان بالا، ظرفیت انرژی خوب و توان خروجی عالی بسازیم.
- مواد آند. فلز پتاسیم دارای مشکلاتی نظیر نگرانیهای ایمنی و پایداری بلندمدت است. مشخص شده است که فلز K دلیل اصلی از کار افتادن باتریهای پتاسیم هوا است. با تعویض فلز K با سایر مواد (مانند BpK) میتوان چرخههای رفت و برگشتی باتریهای پتاسیم هوا را از صد چرخه به هزار چرخه افزایش داد اما ظرفیت انرژی ثقلی BpK به قدر کافی بالا نیست و با الکترولیت DMSO در کاتد سازگار نیست. ساخت مواد جدید برای آند با پتانسیل اکسایش-کاهش پایین، ظرفیت بالا، برگشتپذیری بالا و سازگاری خوب با کاتد اکسیژن بعنوان یکی از مراحل مهم در ساخت باتریهای پتاسیم-اکسیژن/هوا شناخته میشود.
- سیستم بسته. تبدیل سوپراکسید-پراکسید را میتوان به کمک کاتالیست RuO2 انجام داد. ما معتقدیم که توسعه کاتد کاتالیستی مقرون بصرفه و یا ترکیبات واسطهگر واکنش اکسایش-کاهش میتواند بازگشتپذیری KO2/K2O2 را بدون آزادسازی اکسیژن تسهیل بخشد. علاوه بر این، تحقیقات اساسی در مورد سینتیک واکنشهای اکسایش-کاهش KO2/K2O2 و تأثیر الکترولیت روی بازگشتپذیری این واکنشها به ما کمک خواهد کرد تا این سیستم جدید را بهتر درک کنیم.
- باتری پتاسیم هوا در حالت جامد. مشکلات مربوط به ایمنی باتریها از جمله قابلیت اشتعال الکترولیت غیرآبی و تشکیل ساختار شاخهای پتاسیم را میتوان با طراحی باتریهای حالت جامد پتاسیم هوا برطرف کرد. یک باتری اکسیژنی حالت جامد باعث انتقال سریع اکسیژن میشود ولی به الکترولیت جامد شدیدا رسانا نیاز دارد تا ظرفیت و سرعت واکنشها را حداکثر کند. اگرچه باتریهای حالت جامد پتاسیم-اکسیژن باید بیشتر بررسی شوند ولی میتوانند راه را برای ساخت باتریهای پتاسیم هوای امن و کارآمد هموار کنند.
- چگالی انرژی در حالت عملی و ارزیابی هزینه. علیرغم چگالی انرژی بالای باتری پتاسیم هوا در حالت نظری، هزینه ساخت این باتری و چگالی انرژی آن در عمل بررسی نشده است. هزینه تخمینی ساخت باتری K-O2 را میتوان با مقایسه آن با هزینه باتریهای Li-O2 بدست آورد. گالاگر و همکارانش [61] گزارش کردند که هزینه برآورد شده برای ساخت یک باتری Li-O2 بین 70 تا kW/h200 (با در نظر گرفتن تمامی اجزای پیل سوختی) است. با در نظر گرفتن این نکته که قیمت فروش پتاسیم تنها یک پنجم قیمت لیتیوم است و اینکه سیستم K-O2 به کاتالیست نیاز ندارد میتوان گفت که هزینه تقریبی ساخت این باتریها بین 70 دلار و kW/h 5/153 است. در مورد چگالی انرژی در حالت عملی نیز با در نظر گرفتن اینکه ماکزیمم چگالی انرژی به دست آمده در سیستم Li-O2 حدود 11 درصد چگالی انرژی نظری آن است [61] بنابراین میتوان گفت که چگالی انرژی باتری پتاسیم هوا در عمل حدود Wh/kg100 است که قابل مقایسه با باتریهای لیتیوم-یونی نیست اما چگالی انرژی آن را میتوان با حذف لایه سرامیکی و محفظه اکسیژن/محفظه فشار (سیستم بسته) ارتقا بخشید.
[1] Donor number
[2] Diglyme
[3] Passivation
[4] Glyme
[5] Desolvation
[6] Acceptor number
[7] Fractal
[8] Protrusion
[9] Online electrochemical mass spectroscopy
[10] Ex situ
[11] Limiting current
[12] Wetting agent