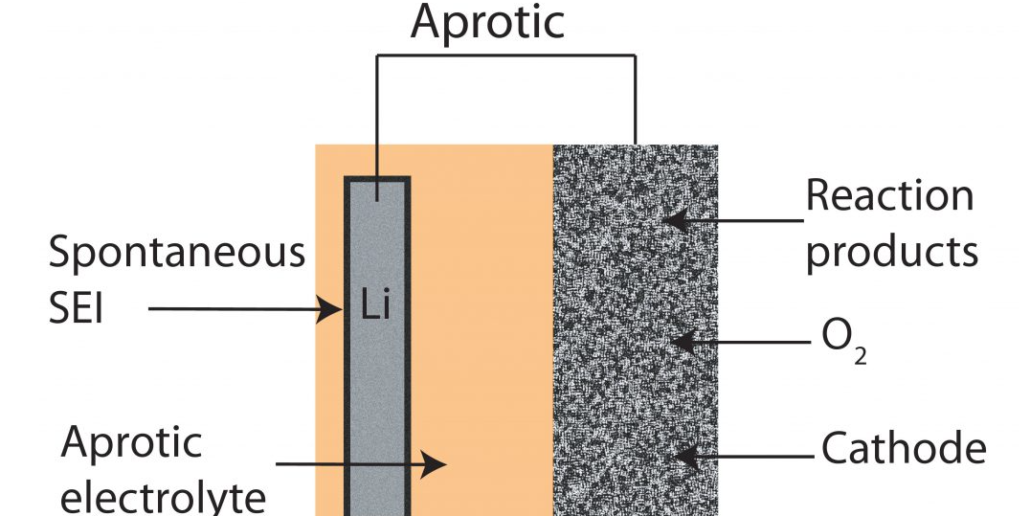
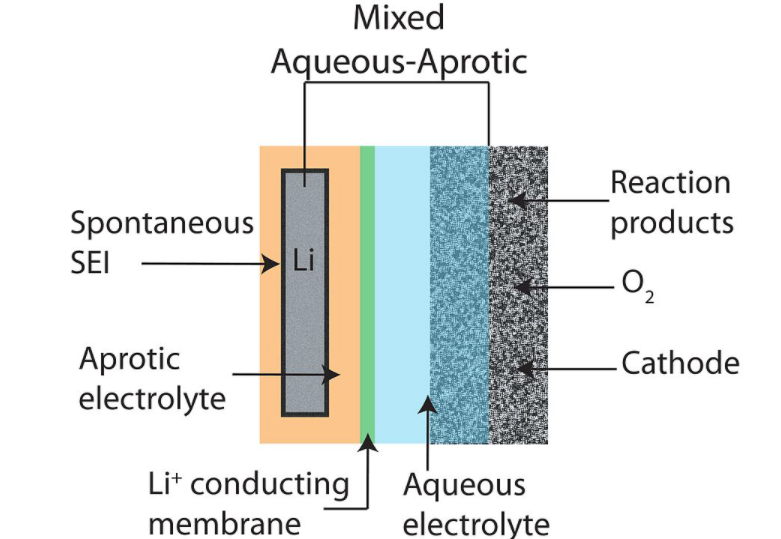
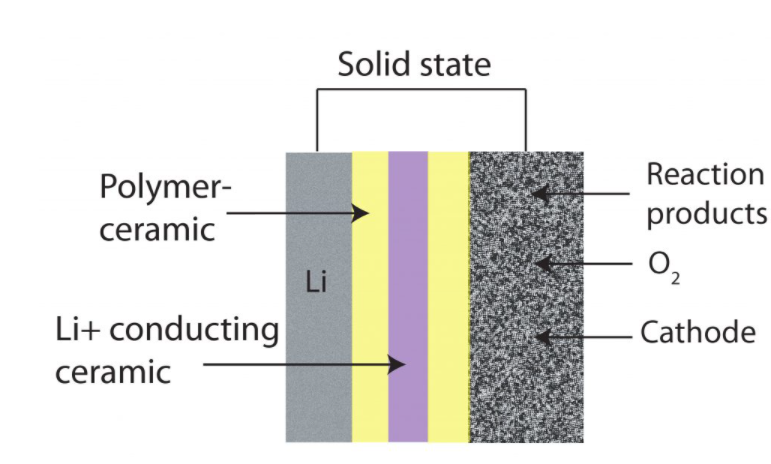
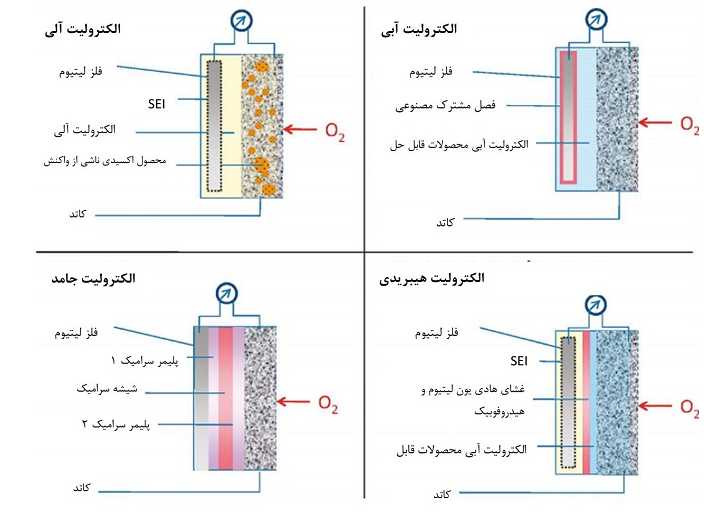
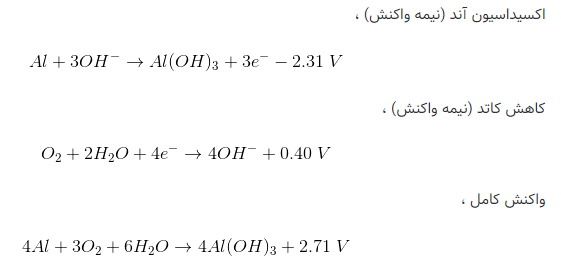باتری سیلیکون هوا؛ پیشرفت، برنامه ها و چالش ها
درباره باتری سیلیکون هوا:
باتری سیلیکون هوا یکی از انواع وسایل ذخیره انرژی است که دارای چگالی انرژی بالایی (Wh/kg 8470) است. این نوع باتری ها دارای مزایای متعددی از جمله فراوانی سیلیکون (سیلیکون دومین ماده فراوان روی زمین است)، غیرسمی بودن محصولات تخلیه و سازگاری با محیط زیست هستند. در این نوع باتری، از سیلیکون خالص، سیلیکون اصلاح شده با نانومواد و سیلیکون دوپ شده می توان به عنوان آند استفاده کرد.
قطب مثبت (کاتد) نیز از ترکیب کربن های با تخلخل ریز و اندازه منافذ مناسب و کاتالیست α-MnO2 ساخته می شود. برای بهره بردای از این باتری ها در مقیاس وسیع، باید مشکلات فنی، طراحی و مباحث مربوط به خوردگی آن برطرف شود. این مرور اطلاعات جامعی در مورد فناوری باتری سیلیکون-هوا ارائه می دهد.
مقدمه
با استفاده از ابزارهای فکری که اسحاق نیوتن و مایکل فارادی در اختیار ما گذاشته اند، می توان همواره در زمینه انرژی های پاک و توسعه تکنولوژیکی کارآمد جامعه قدم برداشت. استفاده گسترده از انرژی همراه با تغییرات آب و هوایی جهانی، رشد و پیشرفت انرژی های تجدیدپذیر و سیستم های ذخیره انرژی را ضروری ساخته است.
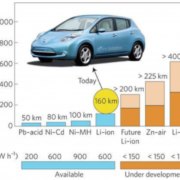
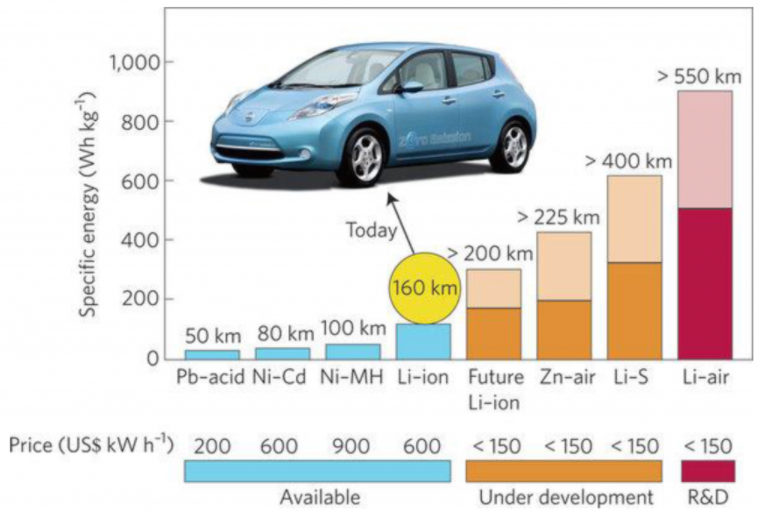
از سوی دیگر لزوم توسعه خودرهای الکتریکی (EV) کشورهای مختلف را بر بهینه سازی حجم و وزن باتری های جدید قابل شارژ متمرکز کرده است. باتری های لیتیوم-یونی با بهره وری بالای انرژی و قابلیت چرخه پذیری مناسب به عنوان محبوبت ترین باتری برای کاربرد در این خودروها تبدیل شده اند. با این حال، ظرفیت پایین ذخیره سازی انرژی ( Wh/kg100-200)، مسائل ایمنی و هزینه های بالای این باتری ها، منجر به فعالیت های تحقیقاتی گسترده برای یافتن فناوری ذخیره انرژی جایگزین شده است.
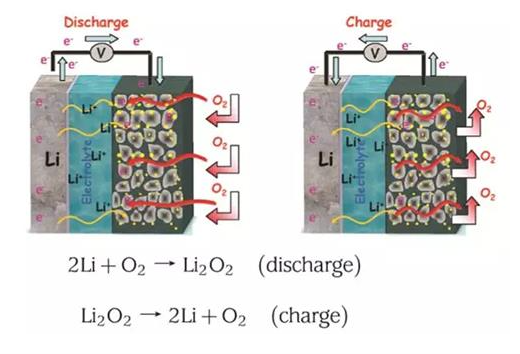
باتری های فلز-هوا مانند Li -air ، Mg -air ، Zn -air ، Al -air و Si -air به عنوان نسل آینده باتری ها، جایگزین امیدوارکننده-ای برای تامین انرژی وسایل نقلیه، تجهیزات صنعتی، رایانه ها، دستگاه های الکترونیکی، سمعک و انواع لوازم جانبی خواهند بود [1-8]. باتری های فلز-هوا علاوه بر دارا بودن چگالی انرژی بالا ( Wh/kg400-1700) دارای ویژگی های مثبتی همچون هزینه پایین، وزن کمتر و سازگاری بالا با محیط زیست هستند [9-15].
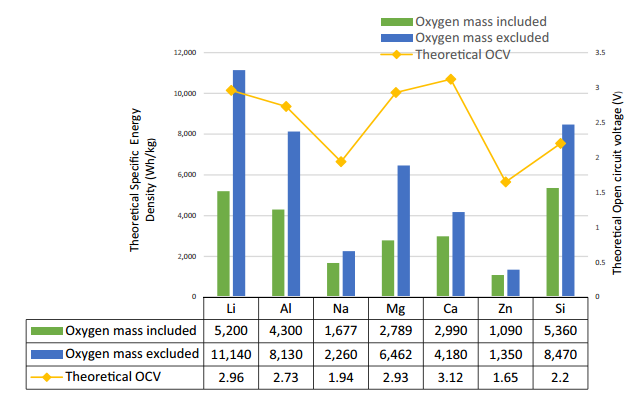
استفاده از هوای محیط (گاز) به عنوان یکی از اجزای اصلی باتری (کاتد)، به جای مواد شیمیایی جامد و پرهزینه ای که در باتری های لیتیومی استفاده می شود، عامل اصلی کاهش وزن (افزایش چگالی انرژی) در این باتری ها است. مطالعات اولیه ای که بر روی باتری های فلز-هوا صورت گرفت با مشکلاتی در سمت کاتد هوا، سیستم مدیریت حرارتی و مسائل فنی ساخت آند مواجه شد. چگالی انرژی نظری و ولتاژهای مدار باز باتری های فلز-هوا در شکل 1 نشان داده شده است.
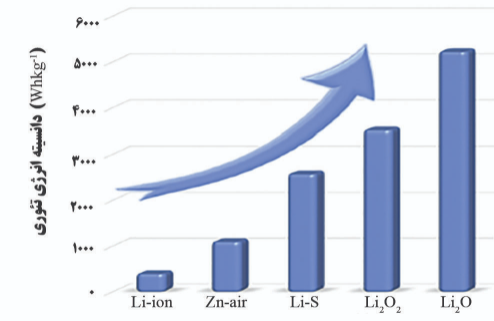
فلز لیتیوم به دلیل دارا بودن انرژی ویژه نظری بالا ( Ah/kg3860)، چگالی پایین (g/cm3 59/0) و کمترین پتانسیل الکترود V045/3 در مقابل SCE) بهترین فلز برای استفاده به عنوان آند محسوب می شود. باتری سیلیکون-هوا دارای چگالی انرژی ویژه ( Wh/kg5360) قابل مقایسه ای با باتری لیتیوم-هوا (Wh/kg5200) است. همچنین، فراوانی سیلیکون در پوسته زمین بسیار بیشتر از لیتیوم (2/28 درصد در مقایسه با 002/0 درصد) است، علاوه بر این سیلیکون ارزان تر از فلز لیتیوم است.
بازدهی عملی برخی از باتری ها از جمله باتری های فلز-هوا در قالب نمودار Ragone نشان داده شده است (شکل 2). در نمودارهای Ragone ارائه شده، باتری های فلز-هوا چگالی انرژی بالاتری از خود نشان داده اند، حالی که باتری لیتیوم یونی قابلیت توان بهتری را ارائه می دهد. همچنین در این نمودار باتری لیتیوم-هوا و سیلیکون-هوا دارای چگالی اترژی تقریبا برابری هستند، اما تفاوت قابل توجهی در قابلیت-های توان (توان به ازای واحد جرم) آن ها وجود دارد. علاوه بر این، قابلیت شارژ مجدد باتری ها سیلیکون-هوا یک کار چالش برانگیز است.
شکل 1- مقایسه چگالی انرژی نظری و ولتاژهای مدار باز (OCVs) باتری های مختلف فلز-هوا
[10]
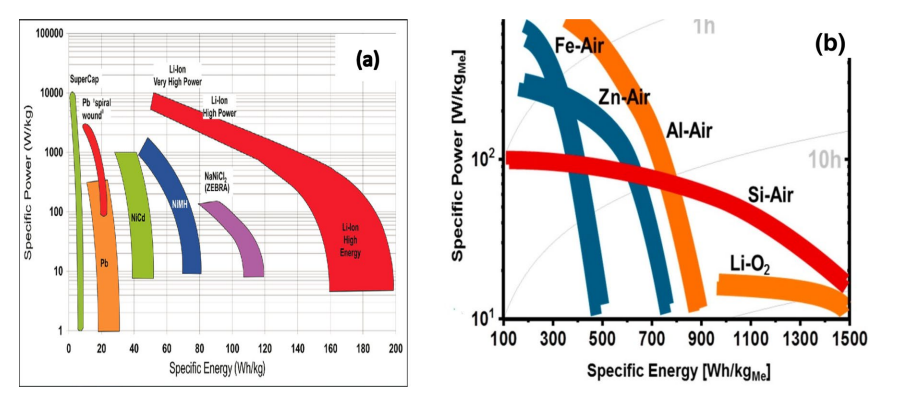
شکل 2-:a نمودار Ragone برای باتری ها؛ b: مقایسه سیستم های مختلف باتری فلز-هوا. محورهای لگاریتمی معمولی در نمودارa به مقیاس لگاریتمی در جهت محور y و مقیاس خطی در جهت x در نمودار b تغییرکرده تا تفاوت بین باتری های فلز-هوا بهتر نشان داده شود.
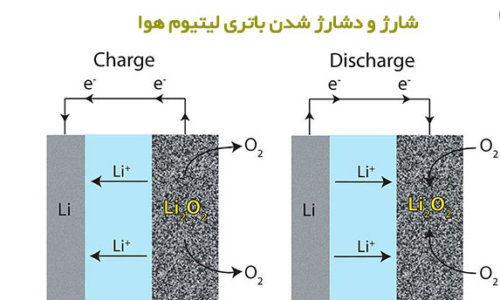
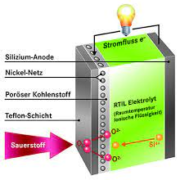
تحقیقات باتری سیلیکون-هوا توسط پروفسور Yair-Ein-Eli و تیمی در موسسه فناوری Technion-Israel در سال 2009 آغاز شد [17]. این باتری اولیه دارای انرژی چگالی انرژی تئوری Wh/kg 8470 و ولتاژ پایدار طولانی مدت 2/1-1 ولت هستند. در این نوع باتری ها از برش های سیلیکونی دوپ شده به عنوان سوخت (آند)، هوا به عنوان کاتد و مایعات یونی سنتز شده EMI·(HF)2·3F)) به عنوان الکترولیت استفاده می شود.
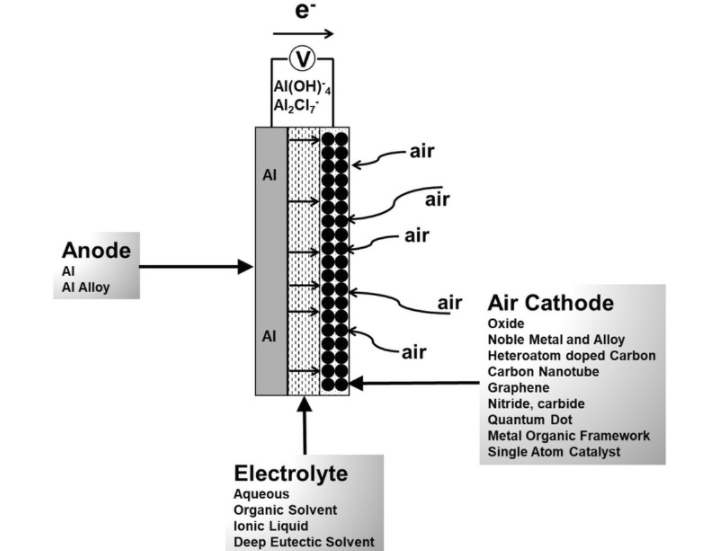
2. ساختار سلول های باتری سیلیکون هوا
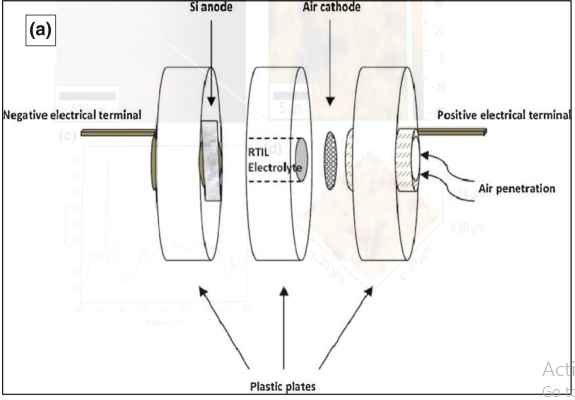
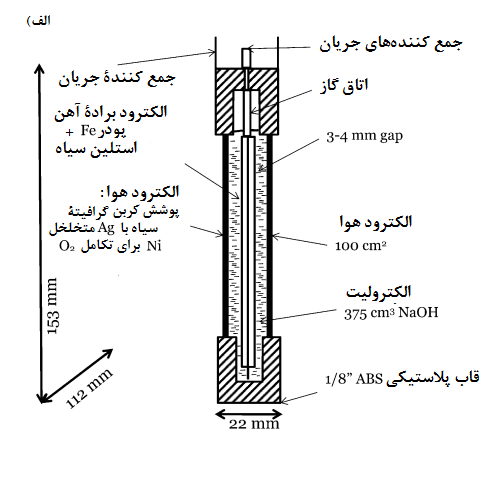
یائر عین الی و همکاران[17]، از یک آند سیلیکون تک کریستال، کاتد هوا و مایع یونی (EMI · (HF) 2 · 3F) به عنوان الکترولیت استفاده کرده اند. نمای شماتیک مجموعه سلول در شکل 3 نشان داده شده است. سلول ساخته شده از سه صفحه پلاستیکی تشکیل شده است. صفحه اول از چند سیلیکون به اندازه 1 سانتی متر در 1 سانتی متر ساخته شده که در حلقه ارینگی فشرده شده است. سطحی از سیلیکون که در معرض الکترولیت قرار دارد معادل 5/0 سانتی متر مربع است. صفحه دوم شامل ورق های دایره ای از الکترودهای گرافیتی با مقطع 5/0 سانتی متر مربع است. صفحه سوم نیز به منظور برقراری تماس الکتریکی مورد استفاده قرار می گیرد.
از سیم های مسی هم برای ایجاد تماس با ترمینال ها استفاده شده است. آندهای سیلیکونی قبل از ساخت سلول مورد فرایند تصفیه قرار گرفته اند. این فرایند شامل غوطه ور کردن سیلیکون در محلول هیدروفلوریک اسید (20 درصد) برای مدت 10 ثانیه است، و سپس تمیز کردن با آب و در نهایت خشک شدن در یک جریان نیتروژن است. این عملیات به منظور حذف لایه اکسید سطحی انجام می شود. مجموعه آند-جداساز-کاتد در سلول متصل شده و 5/0 میلی لیتر مایع یونی به عنوان الکترولیت به ان تزریق شده است. به منظور حفظ رطوبت تمام اجزاء، مجموعه سلول به مدت 4 ساعت در شرایط آماده به کار نگهداری می شود.
3-آند برای سلول سیلیکون هوا
3-1 ویفرها سیلیکون
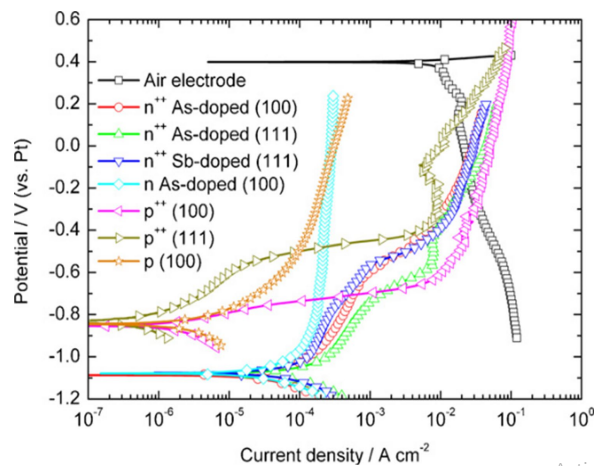
ویفرهای سیلیکونی دوپ شده به طور گسترده ای به عنوان آند در باتری های سیلیکون-هوا استفاده می شود. کریستال های سیلیکون، هم سیلیکون های دوپ شده متوسط (نوع n) و عمیق (نوع ++n)، با یک صفحه فولادی ضد زنگ آمیخته شده با لایه نازک طلا آبکاری شده اند [18]. نرخ خوردگی برای انواع مختلف سیلیکون در شکل 4 نشان داده شده است.
نرخ خوردگی سیلیکون و ولتاموگرافی قطبی مبنایی جهت انتخاب آند مناسب است. همانگونه که مشخص است، سیلیکون ++p دارای نرخ خوردگی کمتر و ولتاژ بهتر در جریان های بالا است. از سویی دیگر، سیلیکون ++n دارای OCV بالاتر و ولتاژ سلول های بهتر در جریان های کم است. اگرچه si++ دارای نرخ خوردگی بیشتری است اما به دلیل ولتاژ بیشتر سلول در مقادیر کم جریان، مورد توجه قرار گرفته است.
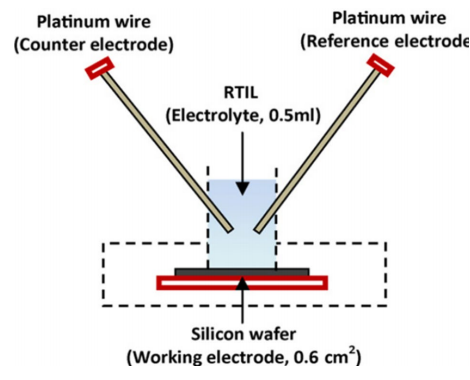
شکل 3- سلول سیلیکون هوا سرهم شده
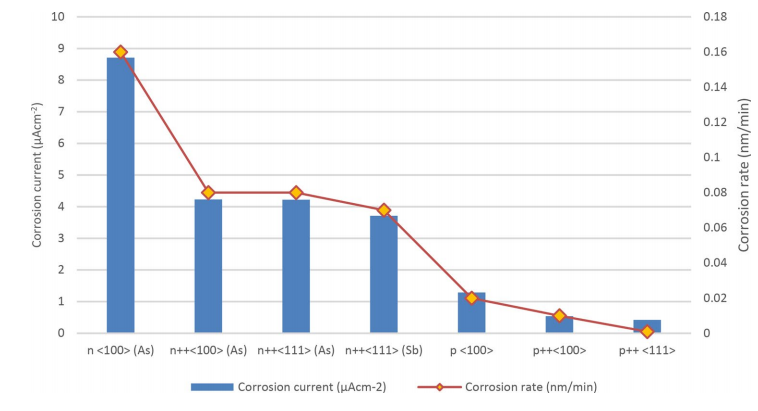
شکل 4- نرخ خوردکی سیلیکون در EMI.(HF)2.3F
3-2 سیلیکون نانوساختار
از سیلیکون نانوساختار به عنوان آند در باتری های لیتیومی جهت غلبه بر ترک خوردگی و پودر شدن استفاده شده است [20 ، 21]. نانوسیم های سیلیکونی که به عنوان آند استفاده می شوند، موجب ایجاد یک تماس الکتریکی بسیار قوی می-شود؛ زیرا هر نانوسیم به طور مستقیم به بستر جمع آوری جریان متصل می شود. مینگ یوان و همکاران [22] به این نتیجه رسیدند که نانوسیم های سیلیکونی متخلخل که با ایچ کردن مستقیم ویفرهای سیلیکونی سنتز می شوند دارای تخلخل و رسانایی الکترونی بالایی هستند.
مزیت های استفاده از این مواد برای آند شامل پایداری ساختاری، عملکرد الکتروشیمیایی بالاتر و عمر طولانی است. پس از 250 چرخه، با نرخ جریان های 2، 4 و A/gr18 ظرفیت 2000 ، 1600 و mAh/gr1100 به دست آمده است. ژونگ و همکاران [23]، از سیلیکون نانوساختار به عنوان ماده آند در طراحی باتری سیلیکون-هوا با الکترولیت قلیایی استفاده کرده اند. در این مطالعه مشخص شده است که آندهای سیلیکونی نانوساختار، شارژ برگشت پذیر مدت عملیات باتری های نسل جدید را افزایش می دهند. لایه اکسید با غوطه ور کردن قطعات سیلیکون تمیز در یک عامل اکسید بافر (BOE) حذف می شوند.
3-3 سیلیکون دوپ شده
سیلیکون دوپ شده با آرسنیک (As) ، آنتیموان (Sb) و بور (B) با جهت های مختلف، <100> و <111> ، به عنوان آند توسط دورموس و همکاران استفاده شده اند [28 ، 29]. از شش نوع آند سیلیکونی زیر استفاده شد.
دوپ شده با آرسنیک، <100>، مقاومت Ω cm 007/0-001/0
دوپ شده با آرسنیک، <111>، مقاومت Ω cm 010/0-001/0
دوپ شده با سرب، <100>، مقاومت Ω cm 020/0-007/0
دوپ شده با سرب، <111>، مقاومت Ω cm 028/0-022/0
دوپ شده با بور، <100>، مقاومت Ω cm 005/0-001/0
دوپ شده با بور، <111>، مقاومت Ω cm 016/0-002/0
تصفیه سطحی دو مرحله ای ویفر دوپ شده با پلاسمای آرگون/اکسیژن برای حذف آلاینده های آلی انجام می شود. لایه های اکسید از سطوح ویفر با کمک پلاسمای هگزافورید آرگون/گوگرد حذف می شوند. مجموعه سلول ساخته شده به مدت 4 ساعت در یک محفظه با دمای 25 درجه سانتی گراد و 50 درصد رطوبت نسبی نگهداری می شود. در این دوره هیچ جریانی از سلول کشیده نمی شود و سلول های سیلیکون-هوا قبل از انجام فرآیند تخلیه در ولتاژ مدار باز خود (OCV) نگه داشته می شوند.
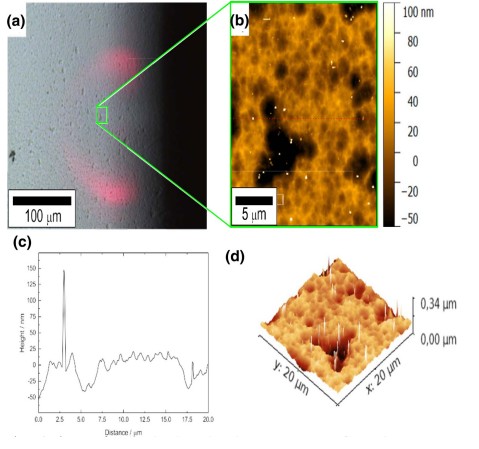
تصاویر سه بعدی مربوط به سطوح <100> و <111> آندهای سیلیکون، در جریان های تخلیه پایین بسیار متفاوت است شکل (5). آندهای سیلیکون، دوپ شده با آرسنیک و آنتیموان با جهت <100> دارای تصاویر سه بعدی یکنواختی هستند، در حالی که آندهای با جهت <111> دارای تصاویر سه بعدی چند ضلعی هستند.
هنگامی که سلول ها در جریان mA/cm2 1/0 به مدت 20 ساعت تخلیه می شوند، مشاهده می شود که ویژگی های سطحی متناظر در مقیاس متوسط برای آندهای دوپ شده با سیلیکون و سرب تقریبا مشابه است. تصاویر سه بعدی از آندهای دوپ شده با بور (نوع P) و (نوع n)، تحت شرایط تخلیه مشابه ، تفاوت های زیادی را در ویژگی های سطحی خود نشان دادند. آندهای دوپ شده با جهت <100> یک سطح همگن با چند منفذ کوچک منفرد دارند، در حالی که آندهای دوپ شده با جهت <111> آندهای جهت دار با ساختار دانه ای تشکیل می دهند.
بنابراین، به دلیل مکانیسم تخلیه متفاوت، ویژگی های سطحی آندهای دوپ شده با بور با آندهای دوپ شده با آرسنیک و آنتیموان تفاوت قابل توجهی دارد. مطالعات انجام شده روی آندهای متفاوت برای باتری های سیلیکون-هوا آندهای دوپ شده n++ را به عنوان انتخابی مناسب برای ولتاژهای بیشتر و جریان پایین سلول معرفی کرده اند.
شکل 5- تصویر سه بعدی از آند دوپ شده با آرسنیک با جهت گیری <100>. a تصویر میکروسکوپ نوری از سطح. b مربع سبزرنگ عکس a توسط AFM. c اسکن خطی از موقعیت مربع سبز، همانطور که در b نشان داده شده است. d بازسازی سه بعدی b
4- کاتد سلول باتری سیلیکون هوا
4-1 کاتد هوا
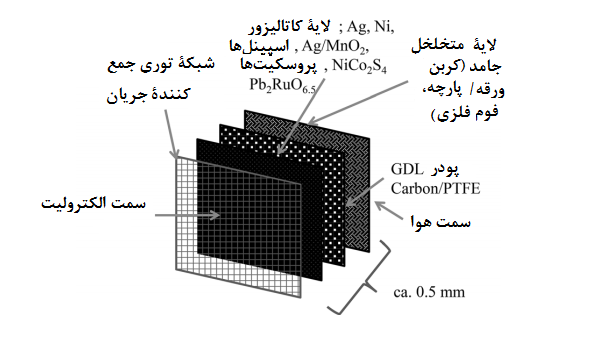
ترکیب و ساختار کاتد هوا نقش مهمی در عملکرد باتری سیلیکون-هوا دارد. در ساخت کاتد، از ترکیب کربن متخلخل با کاتالیزور در کنار یک چسپ پلیمری استفاده می شود. ظرفیت خاص الکترود به عوامل مختلفی بستگی دارد. چنگ و همکاران [30] و شیائو و همکاران. [31] تأثیر سطوح مختلف مواد گرافیتی بر روی ظرفیت ویژه باتری را مورد مطالعه قرار دادند و مشخص شد که این پارامتر متناسب با مساحت سطح است.
\یانگ و همکاران [32] تأثیر اندازه منافذ را بر ظرفیت ویژه سلول مورد بررسی قرار داده و به این نتیجه رسیدند که کاتد هوای ساخته شده با کربن متخلخل (مزوپور) دارای بیشترین ظرفیت است. ضخامت کاتد نیز نقش مهمی در عملکرد سلول دارد. ژانگ و همکاران [33] به این نتیجه رسیدند که سلول های دارای الکترودهای ضخیم تر دارای ظرفیت ویژه کمتری هستند، چرا که در این حالت نفوذ اکسیژن از طریق کاتد کندتر شده و مقاومت انتقال جرم بیشتری در سطح کاتد ایجاد می شود.
بیتی و همکاران [34] نیز گزارش دادند که ظرفیت ویژه سلول با مقدار کربن بارگذاری شده در کاتد نسبت عکس دارد. عامل دیگری که بر عملکرد الکتروشیمیایی الکترود هوا تأثیر می گذارد ، نفوذ اکسیژن از طریق الکترود هوا است که می تواند با افزایش فشار اکسیژن تسهیل شود.
رید و همکاران [35] ، یانگ و شیا [36] و تران و همکاران. [37] گزارش کردند که ظرفیت ویژه سلول به طور خطی با فشار اکسیژن افزایش می یابد. تخلخل، قابلیت تر شدن و تماس الکتریکی الکترودها با نسبت کربن، کاتالیزور و پلیمر تعیین می شود که در نهایت بر عملکرد الکتروشیمیایی سلول تأثیر می گذارد.
4-2 کاتالیست های کاتد هوا
4-2-1 فلزات نجیب
فلزات نجیب مانند پلاتین و آلیاژهای پلاتین به عنوان الکتروکاتالیست واکنش های کاهش اکسیژن مورد استفاده قرار می گیرند. نانوذرات PtAu دارای پایداری بالا و فعالیت کاتالیستی مناسبی برای کاتدهای هوای کربنی پیل های سوختی و باتری هستند. چندین مطالعه [38-41] گزارش کردند که خواص ORR کاتالیست های پلاتین را می توان با تغییر اندازه ذرات به مقیاس نانو و تغییر ویژگی های سطحی بهبود بخشید. درصورتی که کاتالیست پلاتین را با فلزات نجیب دیگر یا فلزات واسطه ترکیب کرد، می توان در عین کاهش هزینه ساخت، عملکرد آن ها را نیز بهبود بخشید [42-47].
4-2-2 مواد کربنی
گرافن و مواد کربنی به عنوان الکتروکاتالیست جهت استفاده در کاتد هوا برای باتری سیلیکونی موارد مناسبی هستند. مواد پایه کربنی به دلیل مزایایی همچون هزینه پایین، در دسترس بودن، مقاومت الکتریکی پایین، سطح بسیار بالا و پایداری در شرایط شدید به عنوان کاتالیست یا پایه کاتالیست مورد توجه قرار گرفته اند [48-64]؛ با این حال عملکرد الکتروشیمیایی این کاتالیست ها به ساختار، ریخت شناسی، اندازه منافذ و ضخامت دیواره آن ها بستگی دارد. پیش تصفیه مناسب سطح مواد کربنی باعث بهبود عملکرد آن و افزایش دوام کاتالیزورهای ORR می شود.
4-2-3 اکسیدهای فلزی واسطه
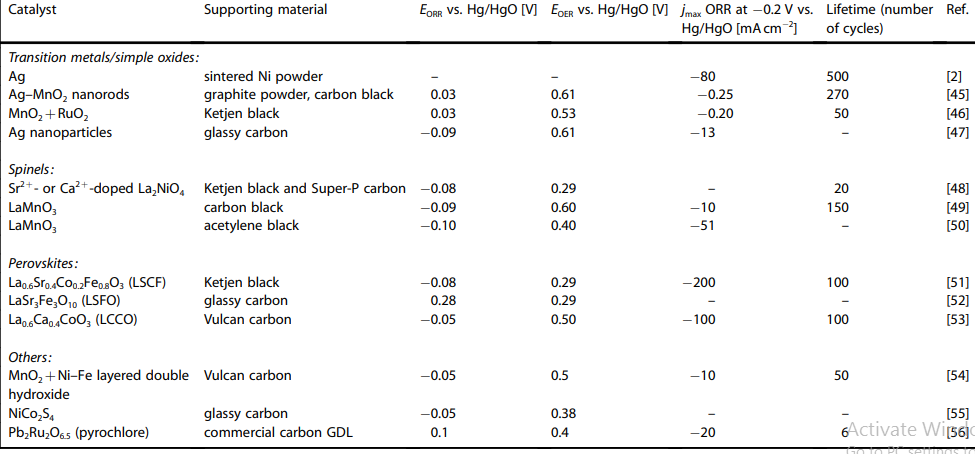
فلزات واسطه با مورفولوژی اسپینلی و پروسکایت کلاس دیگری از الکتروکاتالیست های کاتدی هستند که در سیستم باتری سیلیکون-هوا بسیار مفید هستند [65-67]. این کاتالیست ها دارای پایداری عالی در محیط قلیایی هستند درحالی که پایداری آن ها در الکترولیت اسیدی نسبتاً ضعیف است.
استفاده از اکسیدهای تیتانیوم به عنوان کاتالیست در کنار فلزات نجیب و آلیاژهای آن با فلزات غیرنجیب باعث افزایش فعالیت کاتالیستی آن ها می شود. ظرفیت متغیر فلزات انتقالی مانند Mn ، Co ، Fe و Ni باعث ایجاد چندین ساختار در اکسیدها می شود [71]. اکسیدهای مبتنی بر منگنز به طور گسترده ای به عنوان الکترو کاتالیزور الکترودهای هوا مورد مطالعه قرار گرفته اند. اکسیدهای منگنز الکتروشیمیایی فعال مانند MnO2 ، Mn2O3 ، Mn3O4 و Mn5O8 دارای فعالیت کاتالیزوری بالایی هستند [72-75].
4-2-4 کامپوزیت های معدنی – آلی
ادغام ماتریس های آلی با فلزهای در ابعاد نانو، کامپوزیت های آلی معدنی را تشکیل می دهد. این دسته دیگری از موادی است که به عنوان الکتروکاتالیست استفاده می شود [76-84]. فلزات غیر گران بهای Ni/Fe به راحتی با پلی اکسوماتالات (POM) و (o-Anisidine (oA کامپوزیت تشکیل می دهد و فعالیت کاتالیستی بالا و پایداری مناسبی نسبت به واکنش تکامل اکسیژن (OER) از خود به نمایش می گذارد.
رقابت بین کاتیون های فلزی برای ایجاد ارتباط با کامپوزیت صورت می گیرد. پودرهای نانوساختار Ni xFey (OH) 2 که بر روی بسترهای مختلف با کمک چسب های پلیمری پوشانده شده اند ، فعالیت کاتالیستی بالایی در الکترولیت های قلیایی از خود نشان داده اند. چنین کامپوزیت هایی را می توان با پیرولیز فلز، نیتروژن و کربن تهیه کرد زیرا در محیط های اسیدی یا قلیایی قوی پایدار نیستند.
فعالیت کاتالیستی این کامپوزیت ها به پارامترهای مختلفی همچون فلز، پیش سازها، بستر و روش سنتز بستگی دارد [85]. کامپوزیت های فلزی ساخته شده با پلیمرهای هتروسیکلیک (پلی آنیلین ، پلی پیرول و پلی (3،4-اتیلن دی اکسیتوفن) نیز به عنوان الکتروکاتالیست استفاده شده اند [78 ، 86 ، 87]. حضور یون ها در ماتریس ها باعث ایجاد تعداد زیادی سایت فعال می شود [86]. به علاوه، پل های بین ماتریس و فلز باعث ایجاد تماس فیزیکی و الکتریکی می شوند [87]. کامپوزیت های معدنی – آلی مانند کاتالیست های FeCo EDA در الکترولیت های قلیایی فعالیت ORR مناسبی را از خود نشان داده به گونه ای که فعالیت آن ها تقریباً 3 برابر فعالیت جرمی کاتالیست تجاری Pt/C است.
4-2-5- کربن های دوپ شده با اتم های ناهمگن
نانومواد کربنی دوپ شده با اتم های ناهمگن ((N & S امیدوارکننده ترین کاتالیزور ORR هستند زیرا هزینه را به میزان قابل توجهی کاهش داده و کارآیی سیستم های باتری را افزایش می دهند. فعالیت کاتالیستی نانولوله های کربنی دوپ شده با نیتروژن (VA-NCNT) به عنوان کاتالیست بدون فلز در واکنش ORR 4الکترونی تقریبا سه برابر الکتروکاتالیست Pt/C تجاری موجود در یک سلول قلیایی است [89]. همچنین این کاتالیزورها با CO دچار مسمویت نمی شوند.
چوی و همکاران [93 ، 94] کربن های دوپ شده با (N & S) سنتز کرده و فعالیت الکتروکاتالیستی آن ها را در واکنش های کاهش اکسیژن (ORR) مورد مطالعه قرار داده اند. کاتالیست کربن سنتز شده از سیستئین و دوپ شده با نیتروژن و گوگرد، بالاترین پتانسیل شروع (0.55 ولت در مقابل Ag/ AgCl) و فعالیت الکتروشیمیایی را در محیط اسیدی، یعنی-0.2 میلی آمپر (در 0.2 ولت در مقابل Ag/ AgCl)، از خود نشان داده، که حدود 43% فعالیت Pt/C تجاری (40 درصد وزنی) است.
آن ها باتوجه به مطالعات XPS نشان دادند که در کاتالیزور کربن، گوگرد به عنوان سولفات یا سولفونات دوپ شده است. آن ها همچنین نتیجه گرفتند که علاوه بر دوپ کردن نیتروژن، گوگرد نیز فعالیت الکتروکاتالیستی آن را نسبت به واکنش ORR بهبود بخشیده است. ژانگ و همکاران [95 ، 96]. ورق های نانو کربن
(G-CBP) دوپ شده با گرافن پایه B/N را سنتز کردند.
5- الکترولیت باتری سیلیکون هوا
5-1 مایعات یونی دمای اتاق
مایع یونی دمای اتاق، EMI. (HF) 2 · 3F رایج ترین نوع الکترولیتی است که در باتری سیلیکون-هوا استفاده می شود. EMI (HF) 2 · 3F توسط هاگیوارا و همکاران [97]، از واکنش 1-اتیل-3 متیل ایمیدازولیوم کلرید و هیدروژن فلوراید سنتز می شود.
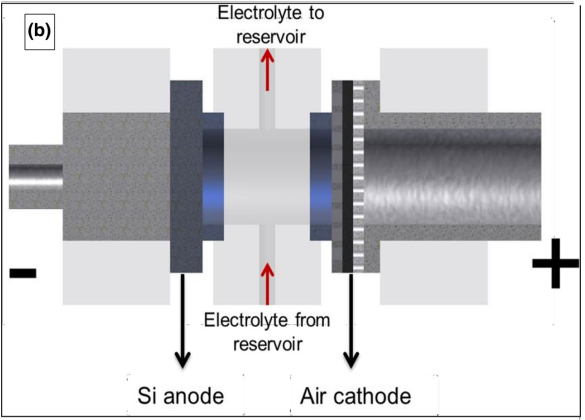
این الکترولیت دارای مزایایی همچون ویسکوزیته پایین، رسانایی بالا در بین مایعات یونی، mS cm-1 100، پایداری شیمیایی در هوا و تحمل بالا در شرایط رطوبت نسبتا شدید است [98 ، 99]. شماتیک سلول سیلیکون هوا که از مایع یونی به عنوان الکترولیت استفاده کرده است در شکل 6 نشان داده شده است.
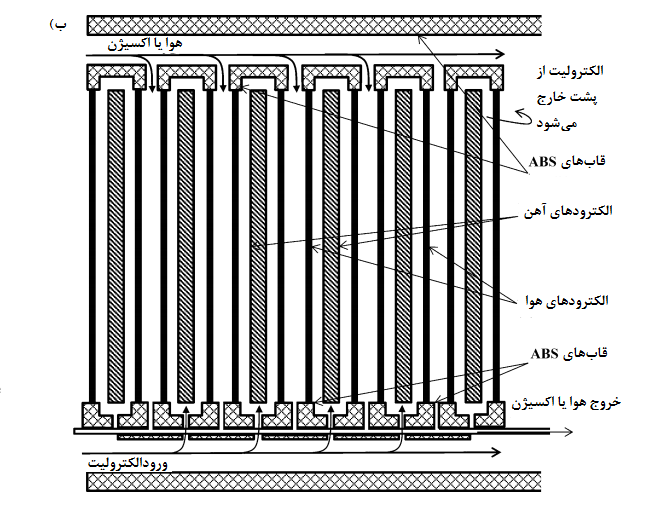
شکل 6- نمودار شماتیک a: باتری سیلیکون هوا [28، 29]؛
شکل 6-b سلول سیلیکون هوا با قابلیت پر شدن مجدد الکترولیت [28، 29].
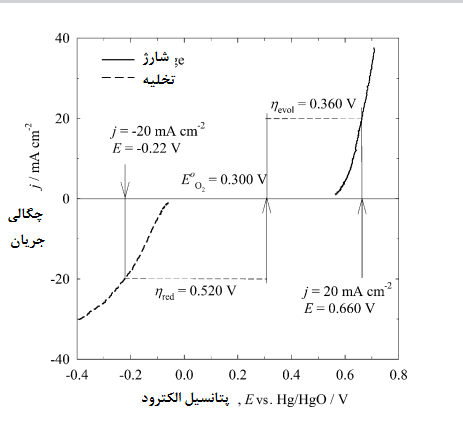
بررسی های پلاریزاسیون پتانسیودینامیکی کوپل ویفر سیلیکون مایع یونی دمای اتاق (نیمه سلول آندی) و الکترود مایع یونی هوا (نیم سلولی کاتدی) برای ارزیابی EMI. (HF) 2 • 3F به عنوان نامزد مناسب برای الکترولیت در سلول های سیلیکون هوا در شکل 7 نشان داده شده است.
شکل 7- ولتاموگرام های پلاریزاسیون که در حضور مایع یونی دمای اتاق [EMI·(HF)2·3F] در پتانسیل mV/s5 برای آندهای تک کریستال سیلیکونی و کاتدهای هوا گرفته شده است .
واکنش های نیم سلولی، واکنش تبلور و واکنش کلی هنگامی که دو آنیون مایع یونی دمای اتاق به اکسیداسیون سیلیکون در آند و کاهش در کاتد هوا کمک می کنند عبارتند از:
آند: Si+12〖(HF)〗_2 F^-↔8〖(HF)〗_3 F^- SiF_4+4e^-
کاتد: O_2+12〖(HF)〗_3 F^-+4e^-↔16〖(HF)〗_2 F^-+2H_2
تبلور: 〖2H〗_2 O+4〖(HF)〗_2 F^-+SiF_4↔4〖(HF)〗_3 F^-+SiO_2
واکنش کلی: Si+O_2↔SiO_2
5-1-1 تاثیر آب در مایعات یونی دمای اتاق
کوهن و همکاران [100] اثر افزودن آب در الکترولیت مایع یونی دمای اتاق را مورد بررسی قرار دادند. آن ها نتیجه گرفتند که عملکرد تخلیه به دلیل رسوب SiO2 روی کربن متخلخل کاتد هوا بسیار محدود می شود. رسوب SiO2 در یک نقطه مشخص کاتد باعث ایجاد مقاومت در نفوذ اکسیژن می شود، که منجر به کاهش ظرفیت تخلیه کاتد نسبت به حالت تئوری خواهد شد.
از آن جا که آب نقش مهمی در تشکیل SiO2 ایفا می کند، بنابراین با افزودن آب به الکترولیت تشکیل SiO2 در سمت جدا کننده یا آند محتمل تر می شود. در صورتی که واکنش تشکیل SiO2 به جای محیط الکترولیت، در مرز مشترک الکترولیت – الکترود رخ دهد، می توان محل جایگزینی برای تشکیل SiO2 ایجاد کرد که باعث خفگی در کاتد هوا می شود که به دلیل از بین رفتن مکان های کاتالیستی موجود در سطح متخلخل کاتد هوا است.
سلول های سیلیکون هوا مورد مطالعه در این پژوهش، با چگالی جریان ثابت mAh/cm2 3/0 و ولتاژ قطع 5/0 ولت آزمایش شده اند. نتایج بدست آمده نشان می دهد که تغییر در محتوای آب در الکترولیت هیچ تاثیری در پتانسیل مدار باز (OCP) برای سلول ندارد.
وابستگی ظرفیت تخلیه سلول به عنوان تابعی از مقدار آب در مایع یونی دمای اتاق مورد در جریان ثابت mAh/cm2 3/0 مورد مطالعه قرار گرفته است. در ابتدا، ظرفیت تخلیه با افزایش مقدار آب، افزایش می یابد و به حداکثر مقدار mAh/cm2 5/72 (در غلظت 15 درصد حجمی آب) می رسد. افزایش مقدار آب (تا 80 درصد حجمی) کاهش شدید (تا 40 درصد) ظرفیت تخلیه سلول را در پی دارد.
با افزایش بیشتر مقدار آب (بیشتر از 80 درصد) سلول عملا جریانی را نشان نمی دهد. با توجه به این نتایج، می توان نتیجه گرفت که افزودن آب در الکترولیت مایع یونی دمای اتاق ممکن است دارای دو اثر متضاد باشد.
یکی، تشکیل SiO2 را در الکترولیت تسهیل می کند که باعث می شود تخلخل الکترود هوا کم و بیش دست نخورده باقی بماند. دوم، فعالیت مایع یونی دمای اتاق در الکترولیت با افزایش محتوای آب کاهش می یابد و منجر به از بین رفتن خواص متمایزکننده آن برای تسهیل واکنش کاتدی می شود.
5-2 الکترولیت ژل پلیمری
الکترولیت های ژل پلیمری با ادغام یک الکترولیت مایع در یک ماتریس پلیمری تشکیل می شوند. اگرچه این الکترولیت ها در حالت جامد هستند اما رسانایی آن ها شبیه الکترولیت های مایع است. استفاده از الکترولیت ژل پلیمری، دغدغه نشت الکترولیت مایع را از بین برده و مسائل فنی معماری سلول را ساده می کند.
انعطافپذیری، پایداری مکانیکی، ایمنی بالا و کاهش اندک رسانایی یونی در طول فرآیند تخلیه باعث شده است که این نوع الکترولیت ها مورد توجه محققین قرار گیرند. از الکترولیت های ژل پلیمری معمولاً در باتری های لیتیوم-یونی، سلول های خورشیدی و حسگرهای شیمیایی استفاده می شود [101-104].
یائر عین الی و همکاران [105]، امکان استفاده از الکترولیت پلیمری کامپوزیتی در باتری-های سیلیکون هوا را مورد بررسی قرار دادند. الکترولیت مورد استفاده از ترکیب مایع یونی EMI.(HF)2.3F و 2-هیدروکسی اتیل متاکریلات (HEMA) به عنوان ماتریس به دست آمده است.
هنگامی که باتری با استفاده از ژل پلیمر حاوی 50 تا 70 درصد مولی مایع یونی با چگالی جریان mAh/cm2 1/0 تخلیه می شود، پتانسیل آن با افزایش مقدار مایع یونی افزایش می یابد.
مشاهده شده است که پتانسیل سلول در ترکیب درصدهای 50، 60 و 70 درصد مولی مایع یونی به ترتیب 4/0، 5/0 و 6/0 ولت بدست آمده است. در مقایسه با پتانسیل تخلیه سلول ها بدر حضور مایع یونی خالص، پتانسیل الکترولیت ژل پلیمری حدود 5/0 ولت کمتر است که به دلیل تفاوت در رسانایی یونی آن هاست. به عنوان مثال، مشاهده شده است که رسانایی یونی الکترولیت حاوی 60 درصد مایع یونی mS/cm 23 است که کمتر از رسانایی یونی مایع خالص است (mS/cm 100) است.
الکترولیت های ژله ای حاوی 40 تا 70 درصد مولی EMI. (HF) 2 · 3F و پلیمر HEMA به صورت ایستاده و از نظر مکانیکی پایدار هستند. این الکترولیت همچنین می تواند به خوبی با آند سیلیکون و کاتد هوا ادغام شود.
سلول متشکل از این الکترولیت ها مدت زمان تخلیه طولانی 850 ساعت را در چگالی جریان mAh/cm2 1/0 از خود نشان داده اند. با این حال، این سلول ها ولتاژ سلول کمتری در مقایسه با سلول های حاوی مایعات یونی خالص دارند. بنابراین، استفاده از الکترولیت های ژل پلیمری در باتری های سیلیکون-هوا برای دستگاه های کم مصرف امکان پذیر است.
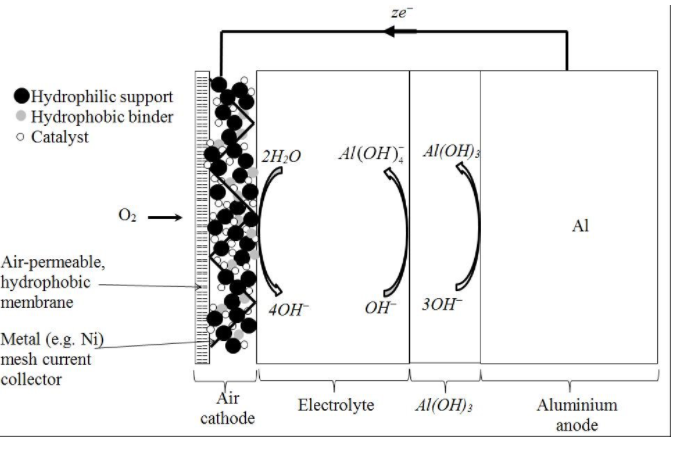
5-3- الکترولیت قلیایی
ژونگ و همکاران [23] عملکرد باتری سیلیکون-هوا اولیه را که از سیلیکون نانوساختار به عنوان آند و الکترولیت شامل محلول قلیایی ساخته شده بود را مورد بررسی قرار دادند. این باتری در تست تخلیه گالوانوستاتیک معمولی، نشان داد که توان تولید mA/cm2 05/0 در یک دوره 30 ساعته با پتانسیل عملیاتی 1.2 ولت را دارد. این در حالی است که با استفاده از ویفر سیلیکونی اصلاح نشده، سلول در کمتر از 10 دقیقه در پتانسیل 1.1 ولت به طور کامل تخلیه می شود. واکنش های صورت گرفته در الکترود عبارتند از:
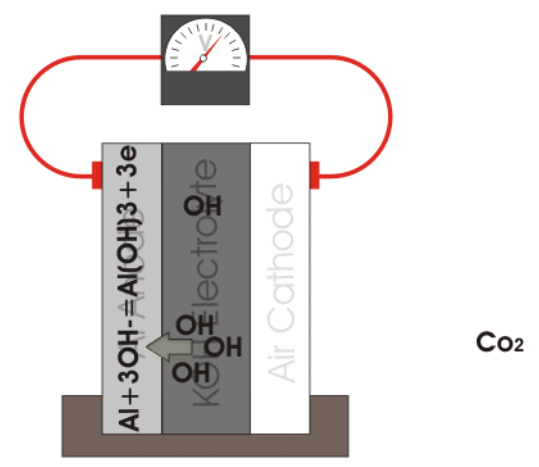
آند: Si+4OH^-↔Si〖(OH)〗_4+4e^- E0=1.69V
کاتد: O_2+〖2H〗_2 O+4e^-↔4OH^- E0=0.40V
انحلال Si(OH)4 در محلول های قلیایی، به عنوان مزیت اصلی استفاده از این الکترولیت ها در سلول های سیلیکونی شناخته می شود. اگر سرعت انحلال Si(OH)4 به اندازه کافی سریع نباشد، سطح آند با اکسید سیلیکون پوشانده می شود.
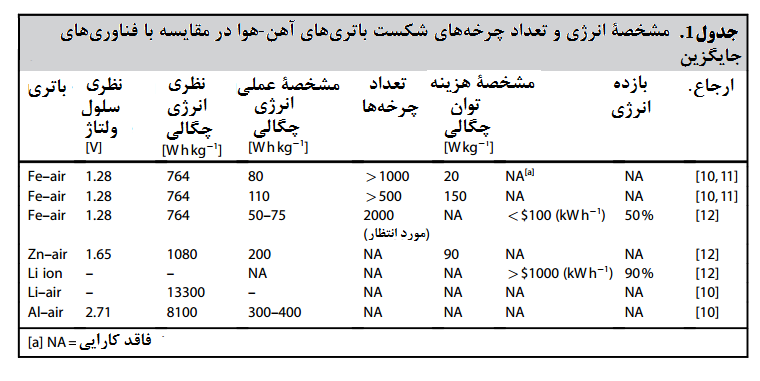
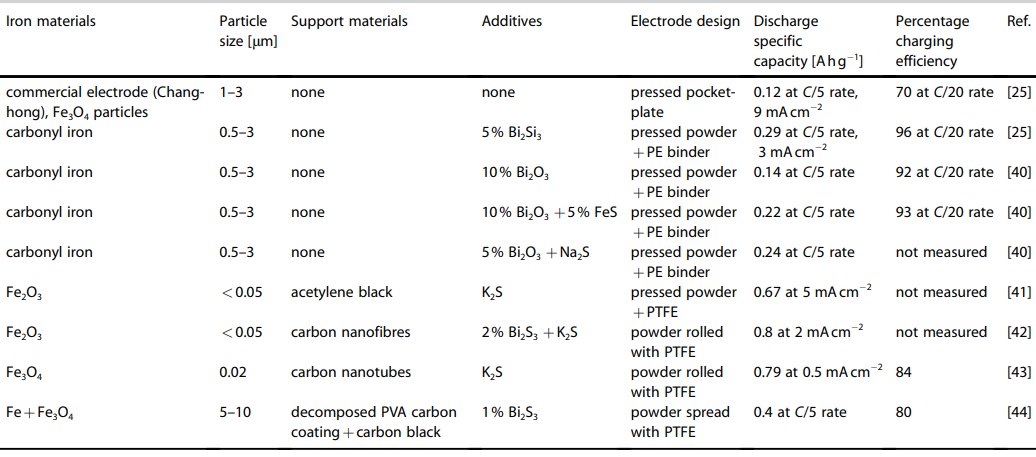
تشکیل یک ساختار متخلخل در روی سطح باعث افزایش سرعت انحلال Si(OH)4 در الکترولیت KOH خواهد شود. این امر حذف موثر اکسید را تسهیل کرده و سطح سیلیکون را مجددا فعال می کند. این در حالی است که، سطح سیلیکون اصلاح نشده خیلی سریع منفعل شده و زمان تخلیه بسیار کوتاهی را ارائه می دهد. در مطالعات صورت گرفته، از غلظت های مختلف محلول های قلیایی به عنوان الکترولیت استفاده شده است. همانطوری که در جدول 1 مشاهده می شود پتانسیل انحلال آندی با غلظت KOH نسبت مستقیم دارد (جدول 1).
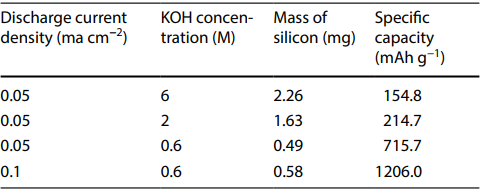
جدول 1- ظرفیت ویژه باتری های سیلیکون هوا
6- نتیجه گیری و چشم انداز باتری سیلیکون هوا
در این مرور کوتاه، خلاصه ای از پیشرفتهای اخیر در حوزه آند سیلیکونی، کاتد هوا، الکترولیتهای مختلف و تأثیر آن ها بر مکانیسمهای تخلیه و پتانسیلهای کاری در سیستم باتری سیلیکون هوا ارائه شده است. علی رغم تحقیقات زیادی که در این حوزه صورت گرفته، هنوز هم فضای زیادی برای پیشرفت بیشتر این باتری ها وجود دارد.
به طور کلی می توان گفت جهت گیری های آینده نگر برای تحقیقات آینده در زمینه باتری های سیلیکون هوا به صورت زیر خواهد بود:
ویفرهای سیلیکونی خالص رایج ترین ماده برای آند سیلیکون هستند، اما نقطه ضعف آن ها نرخ خوردگی بالای آن ها است.
آند مناسب سیلیکون باید بتواند ظرفیت خود را در صدها چرخه تخلیه و شارژ حفظ کند. بنابراین می توان از سیلیکون نانوساختار و سیلیکون دوپ شده برای بهبود عملکرد آند استفاده کرد. تحقیقات نشان داده که تغییرات ساختاری مانند رسوب الکتریکی یا اصلاح شیمیایی با استفاده از مواد افزودنی راه حلی ایده آل برای یافتن چنین ماده آندی است.
افزودنی ها باید در مقادیر کم مورد استفاده قرار گیرد، زیرا مقدار زیاد افزودنی می تواند ظرفیت کلی مواد سیلیکونی را کاهش دهد. مطالعات بیشتری برای درک صحیح مکانیسمهای شارژ و دشارژ برای بهینهسازی زمان تخلیه مورد نیاز است.
کاتد هوا بخشی ضروری از هر نوع باتری فلزی هوا است، اما سینتیک کند واکنش کاهش اکسیژن مانع عملکرد موثر آن می شود؛ به همین دلیل الکتروکاتالیست ها نقش مهمی در عملکرد کاتد دارند. فلزات نجیب مانند پلاتین و کاتالیست های مبتنی بر آلیاژ های پلاتین به طور گسترده در الکترود هوا استفاده می شوند. برای کاهش هزینه، انواع مختلفی از کاتالیست ها مانند کمپلکس فلزات انتقالی با اسپین بالا و کامپوزیتهای معدنی آلی میتوانند به عنوان یک جایگزین بسیار کارآمد استفاده شوند.
مشاهده شده است که ظرفیت ویژه یک الکترود هوا به عوامل مختلفی بستگی دارد. توسعه بیشتر کاتالیزورهای کم هزینه با بهبود فعالیت و دوام برای بهبود سینتیک کند الکترود هوا ضروری است. یکی از این نمونههای الکتروکاتالیست میتواند کاتالیست های دو عملکردی ارزانقیمت باشد که هم برای واکنش تکامل اکسیژن و هم برای واکنش کاهش اکسیژن مناسب است.
بهبود الکترولیت های پایدار جدید که امکان عملکرد طولانی مدت باتریهای سیلیکون-هوا را فراهم میکند برای پیشرفت بیشتر این حوزه مورد نیاز است. در حال حاضر، مایعات یونی امیدوارکنندهترین الکترولیتها برای باتریهای سیلیکونی هستند.
به نظر می رسد الکترولیت ژل پلیمری پایدار از نظر حرارتی و مکانیکی یک جایگزین مناسب به عنوان الکترولیت برای تحقیقات آینده باشد. جامد شدن سیستم الکترولیت برای حفظ عملکرد ایمن و جابجایی آسان باتری و یکپارچگی ساختاری تحت تغییر شکل های مختلف مهم است.
به منظور شناخت دقیق تر و همه جانبه تر باتری های سیلیکون هوا انجام شبیهسازی امری ضروری به نظر می رسد. از طرف دیگر، درک رشد دندریتیک سیلیکون در باتریهای سیلیکون هوا هنوز در مراحل ابتدایی است و لازم است جهت توسعه هرچه بیشتر این فناوری به این حوزه نیز با جدیت پرداخته شود.
[WPSM_AC id=7376]


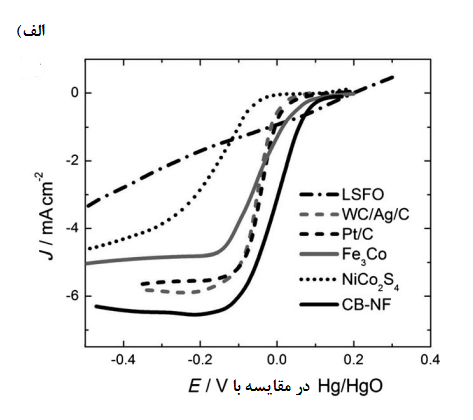
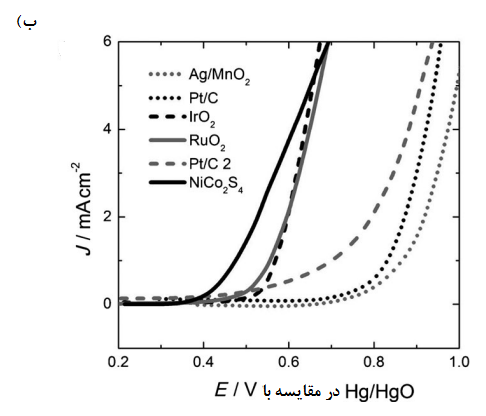
![منحنیهای چگالی جریان در مقایسه با پتانسیل الکترود برای کاهش اکسیژن در الکترودهای انتشار گاز (GDEها) در محلولهای قلیایی غلیظ. CB = کربن سیاه تصفیه نشده [49] - Ag NP = نانوذرات اکسید 10 [47] روی کربن سیاه-](https://novasi.ir/wp-content/uploads/2021/11/9.png)